刘展展 韩利杰 陈露
摘 要:近年来,生活节奏日益加快,心源性猝死发生的比例逐渐升高,人类面临重要挑战,这其中法医病理学工作具有重要意义。主动脉夹层是具有起病急骤、进展迅速、病史不详和死亡率高等特征的一类心源性猝死,易引起家属的质疑及医患纠纷。目前主动脉夹层发生的分子病理学机制尚未完全阐明,CD31作为血管内皮细胞的一种特异性标记物,存在于血管内皮细胞及紧密连接处,对血管的生成和维持血管内膜结构稳定性起着重要作用。本文综述CD31分子在主动脉夹层形成中的可能作用及潜在影响,为后续探讨主动脉夹层发生的分子病理学机制提供参考和借鉴。
关键词:法医病理学;主动脉夹层;PECAM-1/CD31;心源性猝死
中图分类号:R654.4 文献标识码:A 文章编号:1673-260X(2020)10-0049-05
1 研究背景
主动脉夹层(Aortic dissection,AD)又称主动脉夹层动脉瘤,是指主动脉内膜撕裂后,腔内的血液通过内膜破口进入动脉壁中层形成夹层血肿,并沿血管长轴方向扩展,形成动脉真、假腔病理改变的严重主动脉疾病[1]。虽然主动脉夹层发率病占心源性猝死的比例较低,但其具有突发、起病急骤、进展迅速、不可预测和死亡率高等特征,是主动脉疾病中最凶险的急症。据欧洲心脏学会统计,主动脉瘤和主动脉夹层年发病率为5/10-10/10万,全球病死率约2.78/10万[2]。美国心脏协会2006年报道本病年发病率为25/100-30/100万[3],中国流行病学数据显示主动脉夹层的年发病率约为2.8/10万[4]。美国每年至少新发现主动脉夹层3000例,而我国由于人口基数大,主动脉夹层发病人数较欧美国家高,且仍呈上升趋势[5,6]。因主动脉夹层破裂前常无明显的症状和体征,病史不详,抑或部分患者症状不典型而迅速发生死亡,往往引起家属的质疑,且容易造成医患纠纷,因此成为法医病理学工作的重要内容,这也从侧面反应出主动脉夹层的防治工作仍薄弱。综上,阐明主动脉夹层发生的分子病理学机制具有重要的法医学意义,对预防和诊治主动脉夹层亦具有重要意义。
2 主动脉夹层
2.1 主动脉夹层的临床表现
主动脉夹层的临床特点为急性起病且进展快,突发剧烈疼痛、血压升高、心脏以及其他脏器或肢体缺血症状等,主动脉夹层动脉瘤破裂可造成急性心脏压塞,胸腹腔积血,纵隔和腹膜后血肿。
2.2 主动脉夹层的病理分型
(1)根据夹层起源和主动脉受累部位,可将主动脉夹层按DeBakey系统分为三型:
I型:夹层起源于升主动脉,扩展超过主动脉弓到降主动脉,甚至腹主动脉,此型最多见。
II型:夹层起源并局限于升主动脉。
III型:病变起源于降主动脉左锁骨下动脉开口远端,并向远端扩展可直至腹主动脉(IIIa,仅累及胸降主动脉;IIIb,累及胸、腹主动脉)。
(2)Stanford分型将主动脉夹层动脉瘤分为A、B两型:
A型:无论夹层起源于哪一部位,只要累及升主动脉者称为A型(即为DeBakey I型和DeBakey II型)。
B型:夹层起源于胸降主动脉且未累及升主动脉者称为B型(即为DeBakey III型)。
(3)根据主动脉夹层发病时间分为急性期、亚急性期、慢性期,发病时间少于14天為急性期,大于15天少于90天为亚急性期,大于90天为慢性期。
2.3 主动脉夹层的病因、病理和发病机制
主动脉夹层的病因包括两大类:其一为自身因素所致的主动脉夹层,常见于伴有结缔组织异常的遗传性心血管病,是导致原发性主动脉夹层的关键,包括Marfan综合征、Ehlers-Danlos综合征等[7,8],另外,笔者报道的纤维肌性发育不良也是引起动脉夹层的先天性因素之一[9]。高血压是继发主动脉夹层最重要的危险因素,65-75%的主动脉夹层病人合并高血压[10],且多数病人的血压控制欠佳。此外动脉粥样硬化也是主动脉夹层的重要危险因素[11];部分非典型夹层系动脉滋养血管破裂产生血肿后所致[12,13]。其次,各类损伤所导致的主动脉夹层是不可忽视的原因,如交通损伤所致的外伤性主动脉夹层[14],医源性损伤也可导致本病的发生[15],因本文侧重对非外伤性主动脉夹层的发生机制进行综述,在此不讨论外伤因素引起的主动脉夹层。
主动脉夹层的主要病理变化表现为中膜囊性退行性变,但主动脉夹层发生的具体分子病理学机制尚未完全阐明[16]:血管平滑肌细胞(VSMC)是血管中膜重要的细胞成分,Lacolley[17]等人发现血管平滑肌细胞表型转化对主动脉夹层的形成和发展有着重要作用;Leeper[18]等发现miRNA-26a通过改变TGF-β信号通路,抑制血管平滑肌分化和凋亡,同时TGF-β可以通过PI3K-AKT-ID2信号通路促进中膜VSMC细胞由收缩型转化为合成型,导致血管中膜弹性及收缩能力降低,血管壁变脆,进而形成主动脉夹层。基质金属蛋白酶(MMPs)参与降解细胞外基质,使主动脉中膜弹性降低,从而促进主动脉夹层的形成,Wilson[19]等在主动脉夹层破裂口处检测到MMP-8和MMP-9的表达增高;国内罗宝英[20]等研究发现C/EBPβ可能通过调控血管平滑肌细胞凋亡、基质金属蛋白酶MMP2、MMP9的表达和促进炎症因子的产生从而对主动脉瘤和主动脉夹层的发生起到一定作用。炎症因子在主动脉夹层发生发展中起到一定作用:炎症因子TNF、IL-1可以激活NF-kB信号通路,通过IKBKA/IKBKB介导的IKppa B-α磷酸化,导致其降解,从而分解p50/p65,使NF-kB二聚体进入细胞核,激活靶基因转录,促进炎症反应和IL-1、TNF-α的产生,IL-1、TNF-α都可激活MAPK通路与NF-kB信号通路,导致MMP表达上升[21]。miRNA可以通过改变细胞功能,诱导内皮细胞凋亡,对血管系统产生影响,Dong[22]等人研究发现血浆miR-15a和miR-23a是诊断急性主动脉夹层新的潜在生物标记物,这为主动脉夹层的分子病理学诊断提供重要参考。
3 CD31与主动脉夹层
目前主动脉夹层发病机制的研究集中在中膜的病变上,而内膜是动脉管壁的最内层,由内皮细胞和内皮下层组成,内皮细胞在维持血管稳态中起着重要的生理作用,但内皮细胞与细胞之间并不是严密无缝的,相邻内皮细胞间有紧密连接和缝隙连接及10-20nm的间隙。内膜直接感受着血管压力的变化。但无论是伴有高血压和/或动脉粥样硬化等危险因素的夹层形成,还是遗传性或代谢性因素导致的中膜囊性退行性变者,内膜的破裂才是导致夹层形成的使动因素,因此,这就提示血管内膜结构稳定性的异常在主动脉夹层形成中具有重要作用。血小板-内皮细胞粘附分子-1(Platelet endothelial cell adhesion molecule-1, CD31/PECAM-1,以下简称CD31)是免疫球蛋白超家族中的一种跨膜糖蛋白,最早是在20世纪80年代中期被发现并报道[23],1990年其结构首次被明确[24],它高度表达于内皮细胞与细胞之间的连接处,并在血管内皮的生成、内皮细胞间隙的形成和稳定性的维持等方面发挥重要作用[25]。
3.1 CD31的结构特征
CD31的分子量为130 kDa,其中约40%是碳水化合物[26]。研究表明[27,28]:CD31由六个胞外免疫球蛋白样结构域,一个短的跨膜区和富含磷酸化的丝氨酸和酪氨酸的胞质结构域组成。574个氨基酸构成的细胞外结构域由6个同源结构域组成,每个同源结构域约有100个氨基酸,细胞外结构域是肽链的N端部分,带有糖链,负责与配体的识别。细胞质结构域由八个独立的外显子组成,细胞质结构域含有两个共有序列,分别形成两个免疫受体酪氨酸抑制基序(ITIM),ITIM是SH2含酪氨酸磷酸酶2(SHP-2)停泊的特异位点,SHP-2是CD31多种生理学功能的基础。CD31由一75kb基因编码,该基因位于17号染色体长臂的末端[29]。
3.2 CD31的组织分布
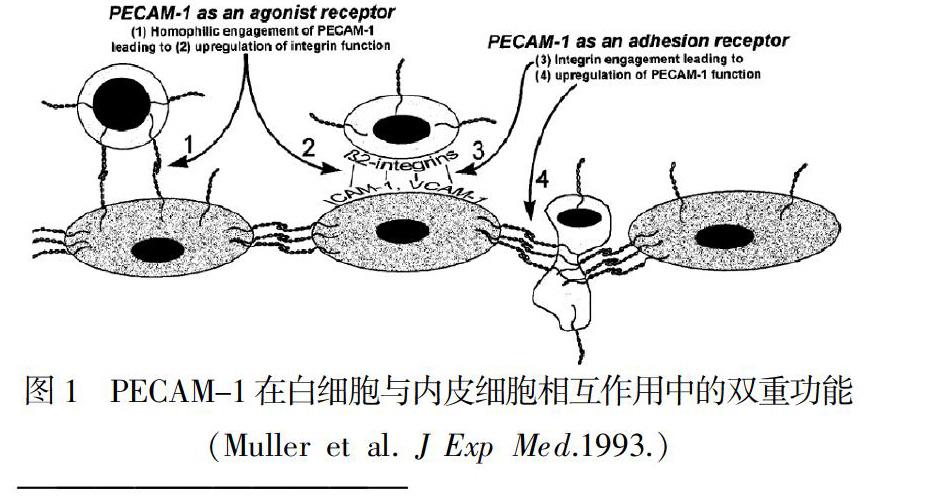
CD31通常位于血管内皮细胞和细胞间紧密连接处、血小板、单核细胞等细胞表面(图1),除少数例外,成纤维细胞、上皮、肌肉或其他非血管细胞中不表达[27,30]。在动脉节段,CD31集中在细胞间内皮边界,与连接分子共同聚集[31]。在一些肿瘤中也发现了CD31的表达,如Kaposi肉瘤与Kaposi肉瘤疱疹病毒感染相关的血管病变中,CD31可作为诊断的内皮标志物[32]。
3.3 CD31的功能
CD31作用范围广泛,大量研究表明CD31在炎症反应、免疫反应和血管生成过程中对白细胞跨过内皮细胞起着至关重要的作用,并参与内皮细胞的迁移、细胞连接的发育及稳态、毛细血管的形成和细胞与细胞外基质相互作用的成熟[25,33]。此外,CD31在信号传导、细胞凋亡、肿瘤等疾病中也具有重要意义。因本文主要综述CD31与主动脉夹层形成之间的潜在作用,以下对CD31与血管屏障之间关系进行重点阐述。
CD31作为血管内皮细胞的一种特异性标记物,参与维持血管内皮细胞结构完整性:Sheibani[34]等发现抗CD31抗体可以抑制生长在基质胶上的内皮细胞形成管状结构的能力,从而可能参与细胞迁移和血管生成。Gao[35]等观察到CD31缺失的小鼠肿瘤血管生成受损。Biswas[36]等发现CD31对于组胺屏障破坏后的血管完整性的恢复很重要。CD31介导的信号传导通常是由702位丝氨酸的磷酸化引发,然后与质膜结合释放ITIM的686位酪氨酸,进而磷酸化Src蛋白激酶家族Lyn,CD31与Lyn共同结合发生酪氨酸磷酸化,与SHP-2结合成复合物,启动Ras信号通路,磷酸化ERK,從而抑制血小板聚集[37]。当内皮细胞CD31表达被抑制时,低剪应力下血小板与内皮细胞的粘附性显著降低[38]。Xu[39]发现在层流条件下,CD31作用于GAB1的上游,促进GAB1/Akt/eNOS的磷酸化和活化,从而对GAB1酪氨酸磷酸化和内皮细胞eNOS信号传导中起作用。这些研究表明CD31对于血管生成和维持血管稳定等方面起着重要作用。
血管屏障对维持血管稳定性具有重要作用,血管屏障功能障碍可导致血管损伤和血管病变:Vandenbroucke[40]等发现血管屏障功能的破坏和血管完整性恢复能力的丧失可能会导致动脉粥样硬化等慢性血管疾病。Chistiakov[41]发现CD31在受动脉粥样硬化影响的血管中功能受损,该事件导致嗜中性粒细胞和其他白细胞与内皮细胞的粘附增加,血管完整性降低以及白细胞向内膜中层的迁移率增加。Komarova[42]发现在正常情况下,通过增强相邻细胞间的黏附和加强细胞外基质组分间的相互作用,可以恢复屏障功能和内皮细胞连接。Carrithers[43]等发现敲除CD31基因的小鼠血管通透性明显增加,从而得出CD31对血管内皮稳定性的维持有着重要作用。Wimmer[44]研究表明CD31在调节血脑屏障通透性中起着重要作用。最近Caligiuri[45]等发现内皮细胞CD31可以指导细胞迁移的方向,而内皮细胞CD31ITIM磷酸化的反式亲和性结合可以激活细胞迁移所需的Gα/鞘氨醇-1磷酸酶/RhoGTP信号,使血管愈合。此外,CD31分子的多态性位点可能与疾病的发生发展相关,如Leu125和Ser563这两个多态性位点的等位基因可能会大大提高患动脉粥样硬化的可能性[46]。CD31促进巨噬细胞的M1到M2表型转换,有利于夹层动脉瘤的愈合[47]。
以上研究表明,CD31在血管内皮迁移、缝隙形成和维持血管稳定性等方面发挥重要作用,而CD31分子表达的异常在主动脉夹层形成中的作用尚不知晓,其功能或表达的异常是否就是主动脉夹层形成的关键因素值得进一步研究。
4 结论与展望
主动脉夹层在法医病理日常检验工作中较为常见,目前流行病学研究表明主动脉夹层死亡人数因超过报道的统计数据,其中重要的原因之一就是很多死者并未来得及去医院救治,就已经发生死亡,而这已经成为法医病理检验工作的中常见的重要内容的原因,特别是对于难以调查或家属刻意隐瞒死者真实病史,但家属又质疑死亡原因并怀疑医院救治不力的案例。本文从法医病理学的视角,综述了不同类型的主动脉夹层发生的原因和影响因素,以及CD31在血管内皮细胞形成和维持内皮细胞结构稳定性等方面的工作进展,推测CD31分子在主动脉夹层形成中的可能作用及潜在影响,以期为主动脉夹层形成过程中的分子病理学机制提供研究思路,为先天性因素所致的主动脉夹层的分子诊断提供参考和借鉴。
參考文献:
〔1〕丛斌.法医病理学[M].第五版.北京:人民卫生出版社,2016.384-387.
〔2〕Erbel R, Aboyans V, Boileau C, et al. 2014 ESC Guidelines on the diagnosis and treatment of aortic diseases:Document covering acute and chronic aortic diseases of the thoracic and abdominal aorta of the adult.The Task Force for the Diagnosis and Treatment of Aortic Diseases of the European Society of Cardiology (ESC)[J]. Eur Heart J, 2014, 35(41):2873-2926.
〔3〕陆再英,钟南山.内科学[M].第七版.北京:人民卫生出版社,2008.352-355.
〔4〕Xia L, Li JH, Zhao K, et al. Incidence and in-hospital mortality of acute aortic dissection in China:
analysis of China Health Insurance Research (CHIRA) Data 2011[J]. J Geriatr Cardiol, 2015, 12(5):502-506.
〔5〕王平凡.主动脉夹层瘤的诊断与治疗[J].医学信息(手术学分册),2006,19(05):3-5.
〔6〕戎天华,潘旭东,刘宁宁,等.Stanford A型主动脉夹层合并急性下肢缺血的临床研究现状与展望[J].心肺血管病杂志,2015,34(11):867-870.
〔7〕Giossi A, Ritelli M, Costa P, et al. Connective tissue anomalies in patients with spontaneous cervical artery dissection[J]. Neurology, 2014, 83(22):2032-2037.
〔8〕Santini F, Luciani GB, Montalbano G, et al. Acute type A aortic dissection:an update on a still challenging disease[J]. J Cardiovasc Med (Hagerstown), 2007, 8 (02):102-107.
〔9〕Xu X, Tsai M, Xiao N, et al. Fatal spontaneous rupture of common iliac artery associated with fibromuscular dysplasia[J]. Forensic Sci Res, 2019, 4(04):358-363.
〔10〕Tsai TT, Trimarchi S, Nienaber CA. Acute aortic dissection:perspectives from the International Registry of Acute Aortic Dissection(IRAD)[J]. Eur J VaSc Endovasc Surg, 2009, 37(02):149-159.
〔11〕Nishigami K. Update on Cardiovascular Echo in Aortic Aneurysm and Dissection[J]. Ann Vasc Dis, 2018, 11(04):437-442.
〔12〕Novikova EG, Titova GP, Galankina IE. Morphological changes in the wall of the aorta in its dissecting aneurysm[J]. Arkh Patol, 2013, 75(06):3-8.
〔13〕李楷,杜思昊,肖宁,等.非高血压主动脉夹层破裂猝死8例法医病理学分析[J].中国法医学杂志,2018,33(02):172-176.
〔14〕徐安宁,田彬.外伤性主动脉夹层法医学鉴定1例[J].中国法医学杂志,2016,31(05):514-514.
〔15〕Januzzi JL, Sabatine MS, Eagle KA, et al. Iatrogenic aortic dissection[J]. Am J Cardiol, 2002, 89(05):623-626.
〔16〕Wu D, Shen YH, Russell L, et al. Molecular mechanisms of thoracic aortic dissection[J]. J Sur Res, 2013, 184(02):907-924.
〔17〕Lacolley P, Regnault V, Nicoletti A, et al. The vascular smooth muscle cell in arterial pathology:a cell that can take on multiple roles[J]. Cardiovasc Res, 2012, 95(02):194-204.
〔18〕Leeper NJ, Raiesdana A, Kojima Y, et al. MicroRNA-26a is a novel regulator of vascular smooth muscle cell function[J]. J Cell Physiol, 2011, 226(04):1035-1043.
〔19〕Wilson WR, Anderton M, Schwalbe EC. Matrix metalloproteinase-8 and -9 are increased at the site of abdominal aortic aneurysm rupture[J]. Circulation, 2006, 113(03):438-445.
〔20〕羅宝英.C/EBPβ在甲基苯丙胺诱导的主动脉瘤及主动脉夹层的作用及调控机制[D].南方医科大学,2018.1-83.
〔21〕Jan Schulze-Luehrmann, Sankar Ghosh. Antigen-receptor signaling to nuclear factor kappa B.[J]. Immunity,2006, 25(05):701-15.
〔22〕Dong J, Bao J, Feng R, et al. Circulating microRNAs:
a novel potential biomarker for diagnosing acute aortic dissection[J]. Sci Rep, 2017, 7(01):12784.
〔23〕Ohto H, Maeda H, Shibata Y, et al. A novel leukocyte differentiation antigen:
two monoclonal antibodies TM2 and TM3 define a 120-kd molecule present on neutrophils, monocytes, platelets, and activated lymphoblasts[J]. Blood, 1985, 66:873–881.
〔24〕Stockinger H, Gadd SJ, Eher R, et al. Molecular characterization and functional analysis of the leukocyte surface protein CD31[J]. J Immunol, 1990, 145(11):3889-3897.
〔25〕Lertkiatmongkol P, Liao D, Mei H, et al. Endothelial functions of platelet/endothelial cell adhesion molecule-1 (CD31)[J]. Curr Opin Hematol, 2016, 23(03):253-259.
〔26〕Newman PJ, Berndt MC, Gorski J, et al. PECAM-1 (CD31) cloning and relation to adhesion molecules of the immunoglobulin gene superfamily[J]. Science, 1990, 247:1219-1222.
〔27〕Newman PJ, Newman DK. Signal transduction pathways mediated by PECAM-1:
new roles for an old molecule in platelet and vascular cell biology[J]. Arterioscler Thromb Vasc Biol, 2003, 23(06):953-964.
〔28〕Paddock C, Zhou D, Lertkiatmongkol P, et al. Structural basis for PECAM-1 homophilic binding[J]. Blood, 2016, 127(08):1052-1061.
〔29〕Gumina RJ, Kirschbaum NE, Rao PN, et al. The human PECAM1 gene maps to 17q23[J]. Genomics, 1996, 34(02):229-232.
〔30〕Newman PJ. Switched at birth:
a new family for PECAM-1[J]. J Clin Invest, 1999, 103(1):5-9.
〔31〕Caligiuri G. CD31 as a Therapeutic Target in Atherosclerosis. Circ Res. 2020;126(09):1178‐1189.
〔32〕Pantanowitz L, Moses AV, Früh K, et al. CD31 immunohistochemical staining in Kaposi Sarcoma[J]. Arch Pathol Lab Med, 2012, 136(11):1329.
〔33〕Privratsky JR, Newman PJ. PECAM-1:regulator of endothelial junctional integrity[J]. Cell Tissue Res, 2014, 355(03):607-619.
〔34〕Sheibani N, Newman PJ, Frazier WA. Thrombospondin-1,a natural inhibitor of angiogenesis, regulates Platelet-Endothelial Cell Adhesion Molecule-1 expression and endothelial cell morphogenesis[J]. Mol Biol Cell, 1997, 8(07):1329-1341.
〔35〕Cao G, Fehrenbach ML, Williams JT, et al. Angiogenesis in platelet endothelial cell adhesion molecule-1-null mice[J]. Am J Pathol, 2009, 175(02):903-915.
〔36〕Biswas P, Canosa S, Schoenfeld D, et al. PECAM-1 affects GSK-3β-mediated β-catenin phosphorylation and degradation[J]. Am J Pathol, 2006, 169(01):314-324.
〔37〕P Carmeliet,R K Jain. Angiogenesis in cancer and other diseases[J]. Nature:
International weekly journal of science,2000,407(6801):249-57
〔38〕Daphne Meza,Saravan K Shanmugavelayudam,Arielys Mendoza,et al. Platelets modulate endothelial cell response to dynamic shear stress through PECAM-1[J]. Thromb Res,2017,150:44-50.
〔39〕Suowen Xu,Chang Hoon Ha,Weiye Wang,et al. PECAM1 regulates flow-mediated Gab1 tyrosine phosphorylation and signaling[J]. Cell Signal,2016,28(03):117-124.
〔40〕Vandenbroucke E, Mehta D, Minshall R, et al. Regulation of endothelial junctional permeability[J]. Ann N Y Acad Sci, 2008, 1123:134-145.
〔41〕Chistiakov DA, Orekhov AN, Bobryshev YV. Endothelial PECAM-1 and its function in vascular physiology and atherogenic pathology[J]. Exp Mol Pathol, 2016, 100(03):409-415.
〔42〕Komarova Y, Malik AB. Regulation of endothelial permeability via paracellular and transcellular transport pathways[J]. Annu Rev Physiol, 2010, 72:463-493.
〔43〕Carrithers M, Tandon S, Canosa S, et al. Enhanced susceptibility to endotoxic shock and impaired STAT3 signaling in CD31-deficient mice[J]. Am J Pathol, 2005, 166(01):185-196.
〔44〕Wimmer I, Tietz S, Nishihara H, et al. PECAM-1 Stabilizes Blood-Brain Barrier Integrity and Favors Paracellular T-Cell Diapedesis Across the Blood-Brain Barrier During Neuroinflammation[J]. Front Immunol, 2019, 10:711.
〔45〕Caligiuri G. Mechanotransduction, immunoregulation, and metabolic functions of CD31 in cardiovascular pathophysiology[J]. Cardiovasc Res, 2019, 115(09):1425-1434.
〔46〕F Andreotti, I Porto, F Crea, et al. Inflammatory gene polymorphisms and ischaemic heart disease:
review of population association studies.[J]. Heart (British Cardiac Society),2002,87.2.107.
〔47〕Francesco Andreata, Varouna Syvannarath, Marc Clement, et al. Macrophage CD31 Signaling in Dissecting Aortic Aneurysm.[J]. J Am Coll Cardiol,2018,72(01):45-57.
猜你喜欢 磷酸化内皮细胞夹层 HSP70及其磷酸化在下肢动脉硬化闭塞症中的表达及临床意义中国现代医生(2021年7期)2021-04-29“糖衣”告诉细胞何时造血科学大观园(2021年1期)2021-01-11欧当归内酯A对实验性纤维化肝脏NO及内皮细胞功能的影响世界中医药(2020年19期)2020-11-18主动脉夹层,比心梗更要命!家庭科学·新健康(2019年11期)2019-12-10黄芪多糖对大鼠脑卒中后抑郁的影响中国医药导报(2019年7期)2019-05-13主动脉夹层,比心梗更要命!养生保健指南(2019年12期)2019-01-30热休克蛋白27的磷酸化及其在胁迫应激中的作用科教导刊·电子版(2018年9期)2018-06-07激素性股骨头坏死发生机制的新认识中国医药导报(2017年34期)2018-01-29磷酸化肽富集新方法研究进展分析化学(2017年12期)2017-12-25非复杂性Stanford B型主动脉夹层动脉瘤的治疗进展中国医药导报(2017年17期)2017-07-27