闫巍巍 章斌 朱志鹏 周红梅

[摘要] 目的 探讨Nrf2/HO-1自噬信号通路在右美托咪定抑制大鼠肺损伤的作用。
方法 SPF级健康成年雄性SD大鼠50只,采用随机数字表法将大鼠分为5组(n=10):正常对照组、模型组(腹腔注射LPS 5 mg/kg)、右美托咪定组(造模前30 min內腹腔注射右美托咪定30 μg/kg)、Nrf2抑制剂鸦胆子苦醇组(模型制备前10 d,隔天腹腔注射鸦胆子苦醇0.4 mg/kg),鸦胆子苦醇+右美托咪定组(剂量和给药时间同前)。收集左肺支气管肺泡灌洗液,ELISA 检测中白细胞介素-1β(IL-1β),白细胞介素-6(IL-6)和肿瘤坏死因子-α(TNF-α)水平,取右肺组织进行 HE 染色并进行肺损伤评分,计算肺组织湿重/干重(W/D)的比值,Western blot 检测肺组织中 Nrf2,HO-1,ATG-5,P62蛋白的表达。
结果 与正常对照组比较,模型组的W/D 比值,肺损伤评分, IL-1β、IL-6和TNF-α水平,Nrf2,ATG-5和P62蛋白明显增加,HO-1蛋白明显下降(P<0.05),与模型组比较,而右美托咪定组、鸦胆子苦醇组和鸦胆子苦醇+右美托咪定组明显逆转(P<0.05),且鸦胆子苦醇+右美托咪定组逆转更为明显(P<0.05)。右美托咪定组、鸦胆子苦醇组和鸦胆子苦醇+右美托咪定组明显逆转模型组大鼠肺组织损伤程度,肺间质增厚明显减少,且炎症细胞浸润程度明显减轻,其中鸦胆子苦醇+右美托咪定组大鼠改变最为明显。
结论 Nrf2/HO-1自噬信号通路参与了右美托咪定减轻大鼠肺损伤的过程。
[关键词] Nrf2/HO-1通路;右美托咪定;大鼠肺损伤;自噬;鸦胆子苦醇;炎症因子
[中图分类号] R363 [文献标识码] A [文章编号] 1673-9701(2021)34-0031-04
[Abstract] Objective To explore the effect of Nrf2/HO-1 autophagy signaling pathway in the inhibition of lung injury in rats by dexmedetomidine(Dex). Methods Fifty healthy adult male SD rats (SPF-grade) were selected and divided into five groups using the random number table method (n=10). These groups were normal control group, model group (intraperitoneal injection of LPS 5 mg/kg), Dex group (intraperitoneal injection of Dex 30 μg/kg in 30 min before modeling), Nrf2 inhibitor brusatol group (intraperitoneal injection of brusatol 0.4 mg/kg every other day 10 d before model preparation), brusatol+Dex group (dose and administration time as before). Left bronchoalveolar lavage fluids were collected, in which interleukin-1β (IL-1β), interleukin-6 (IL-6) and tumor necrosis factor-α (TNF-α) levels were detected by ELISA. Right lung tissues were obtained for HE staining and lung injury scoring, the ratios of wet weight/dry weight(W/D) of lung tissues were calculated, and the expression of Nrf2, HO-1, ATG-5, and P62 proteins in lung tissues were detected by Western blot. Results The W/D ratio, lung injury scores, IL-1β, IL-6 and TNF-α levels, Nrf2, ATG-5 and P62 proteins were significantly increased in the model group and HO-1 protein was significantly decreased than those in the normal control group(P<0.05). However, those in Dex group, brusatol group and brusatol+Dex group were significantly reversed(P<0.05) than those in the model group, and the reversions in the brusatol+Dex group were more significantly(P<0.05). The damage degree of lung tissue was significantly reversed and the pulmonary interstitial thickening was significantly reduced, and the degree of inflammatory cell infiltration was significantly reduced in rats of Dex group, brusatol group and brusatol+Dex group than those in the model group, with the most obvious changes in the brusatol+Dex group. Conclusion Nrf2/HO-1-autophagy signaling pathway is involved in the attenuation of lung injury by Dex in rats.
[Key words] Nrf2/HO-1 pathway; Dexmedetomidine; Lung injury in rats; Autophagy; Brusatol; Inflammatory factors
急性肺損伤是临床上常见的危重症,常由感染性休克或全身炎症反应引起,可进展为急性呼吸窘迫综合征,是导致重症患者病死的首要因素[1-2]。目前关于急性肺损伤的发病机制虽已进行不少研究,但确切的机制尚未阐明,目前国内外学者一致认同炎症级联反应在其中发挥不可或缺的作用[3]。核转录因子红细胞系 2p45 相关因子2(Nrf2)是一种重要的机体内保护性转录因子[4],活化后可由细胞质转至核内,诱导下游抗氧化及抗炎分子如血红素加氧酶-1(HO-1)上调[5],近年来随着对Nrf2/HO-1通路的深入了解,Nrf2/HO-1通路还参与自噬调节,通过影响机体自噬过程参与生理学过程,而自噬在急性肺损伤中亦扮演作用,但Nrf2/HO-1通路调控自噬过程参与急性肺损伤的研究尚未见诸于报道[6-7]。呼吸机支持治疗在急性肺损伤中发挥重要作用,其中右美托咪定作为常见的镇静、镇痛药物,由于其具有不抑制呼吸和维持血流学稳定等特点在临床应用中颇受关注[8]。最近的研究表明,右美托咪定还具有抗炎、抗氧化和抗凋亡作用[9]。本研究拟探讨Nrf2/HO-1信号通路调控自噬过程在右美托咪定减轻急性肺损伤中的作用,为明确其机制提供理论依据。
1 对象与方法
1.1实验对象
50只SPF 级雄性 SD 大鼠,体重为(200±20)g,由本院实验动物中心提供。
1.2 主要试剂及仪器设备
右美托咪定(江苏恒瑞医药股份有限公司,国药准字 H20090248),Nrf2抑制剂鸦胆子苦醇购自上海源叶生物科技有限公司,白介素-1β(Interleukin-1β,IL-1β),IL-6和肿瘤坏死因子-α(Tumor necrosis factor-α,TNF-α)酶联免疫吸附(ELISA)试剂盒购自 R&D公司,LPS购自Sigma公司,一抗:Nrf2,HO-1,ATG-5,P62和β-actin 抗体购自美国 Cell Signaling 公司,辣根过氧化物酶标记的羊抗兔抗、BCA 蛋白定量试剂盒、ECL 化学发光显色系统购自碧云天生物技术有限公司。电泳及凝胶成像系统购自Bio-Rad 公司。
1.3 方法
采用随机数字表法将大鼠分为5组(n=10):正常对照组、脓毒症急性肺损伤组(模型组)、右美托咪定组、Nrf2抑制剂鸦胆子苦醇组和鸦胆子苦醇+右美托咪定组。模型组参照文献[10]中的方法,腹腔注射LPS制备大鼠急性肺损伤模型:腹腔注射1%戊巴比妥钠30 mg/kg麻醉后,仰卧位固定,用拔出管芯的静脉留置针(22G)经声门向小鼠气管内注入LPS 5 mg/kg(溶于100 μL无菌生理盐水中),注射完成后,用1 mL注射器注入0.5 mL空气并轻轻旋转小鼠使LPS在肺内均匀分布。右美托咪定组、鸦胆子苦醇+右美托咪定组于造模前30 min内腹腔注射右美托咪定30 μg/kg。Nrf2抑制剂鸦胆子苦醇组、鸦胆子苦醇+右美托咪定组于模型制备前10 d,隔天腹腔注射鸦胆子苦醇0.4 mg/kg。本研究经医院实验动物伦理委员会批准。所有操作均符合伦理要求。
1.4 观察指标
1.4.1标本采集 建模 6 h 后处死大鼠,灌洗并收集左肺支气管肺泡灌洗液,2500 rpm 4 ℃离心10 min,取上清待测。同取右肺组织,一份于-80℃保存,另一份于福尔马林固定。
1.4.2 酶联免疫吸附试验(ELISA)检测炎症因子水平 根据试剂盒说明书步骤检测肺泡灌洗液上清液中IL-1β、IL-6和TNF-α水平。
1.4.3计算肺湿重/干重(W/D)比 选取新鲜右肺组织,分别称量湿重和干重,计算 W/D比。
1.4.4肺组织HE染色 取右肺中叶组织用 4%多聚甲醛固定 48 h。固定完全后制作 HE 染色切片,按照 Murakami 法[11]评测肺损伤的程度。
1.4.5 Western blot检测蛋白表达 提取肺组织蛋白,定量,各组取50 μg蛋白样本加入上样缓冲液后开水煮沸5 min,SDS-PAGE电泳,采用半干法转膜,PVDF膜放入封闭液中常温封闭1 h,孵育一抗Nrf2,HO-1,ATG-5,P62,4℃孵育过夜,TBST洗膜,室温孵育二抗1 h后,TBST洗膜,发光、显影后拍照并分析图像,β-actin 作为内参,计算相对表达水平。
1.5 统计学方法
应用 SPSS 19.0 统计学软件分析所得数据。服从正态分布的计量资料以均数±标准差(x±s)表示,应用单因素方差分析多组间差异,两两比较应用LSD-t检验。P<0.05为差异有统计学意义。
2 结果
2.1各组大鼠 W/D 比值及肺损伤评分比较
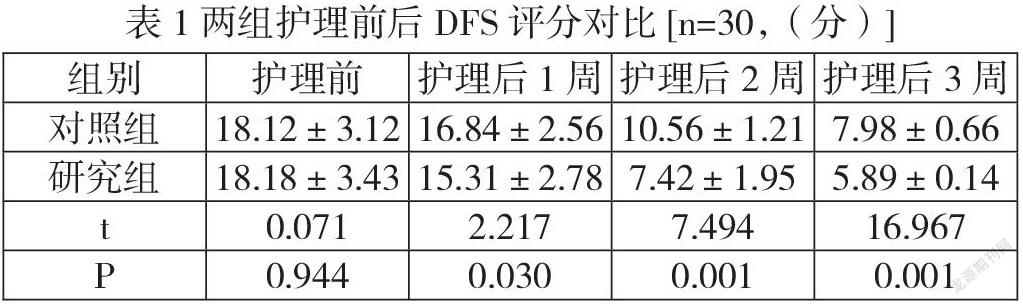
与正常对照组比较,模型组 W/D 比值、肺损伤评分明显增加(P<0.05),与模型组比较,右美托咪定组、鸦胆子苦醇组和鸦胆子苦醇+右美托咪定组W/D比值、肺损伤评分明显降低(P<0.05),且鸦胆子苦醇+右美托咪定组下降更为明显(P<0.05)。见表1。
2.2 各组大鼠炎症因子水平比较
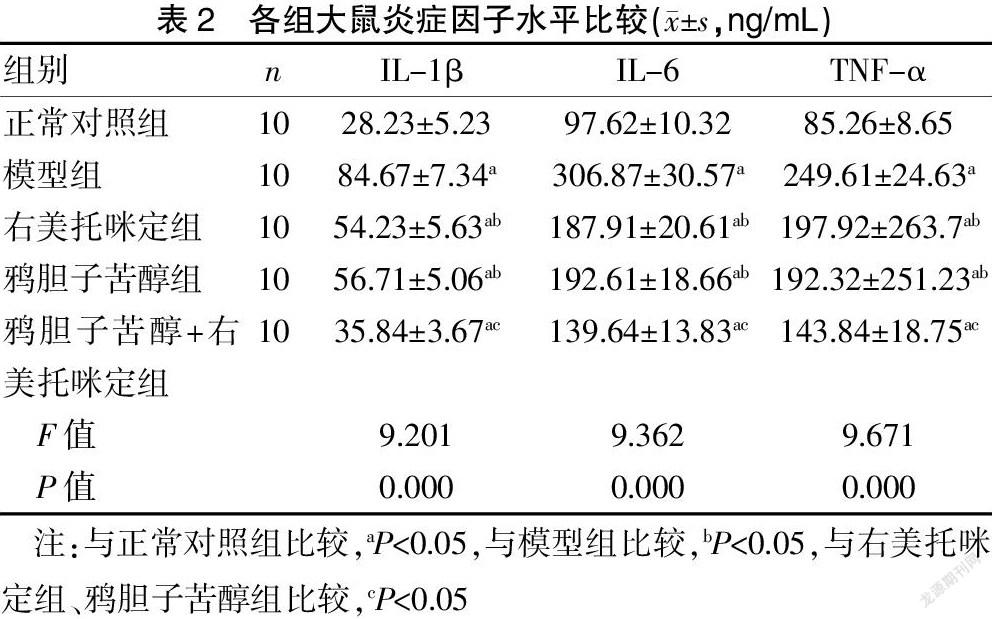
与正常对照组比较,模型组 IL-1β、IL-6和TNF-α水平明显增加(P<0.05),与模型组比较,右美托咪定组、鸦胆子苦醇组和鸦胆子苦醇+右美托咪定组明显降低(P<0.05),且鸦胆子苦醇+右美托咪定组下降更为明显(P<0.05)。见表2。
2.3 各组大鼠HE染色结果
与正常对照组比较,模型组肺泡组织结构遭受明显破坏,肺泡间隔亦明显增厚,肺泡及肺间质渗出红色物质,大量炎症细胞浸润,肺组织受到严重损伤。与模型组比较,右美托咪定组、鸦胆子苦醇组和鸦胆子苦醇+右美托咪定组大鼠肺组织损伤程度明显减轻,肺间质增厚明显减少,且炎症细胞浸润程度明显减轻,其中鸦胆子苦醇+右美托咪定组大鼠改变最为明显。见封三图3。
2.4 各组大鼠WB检测结果
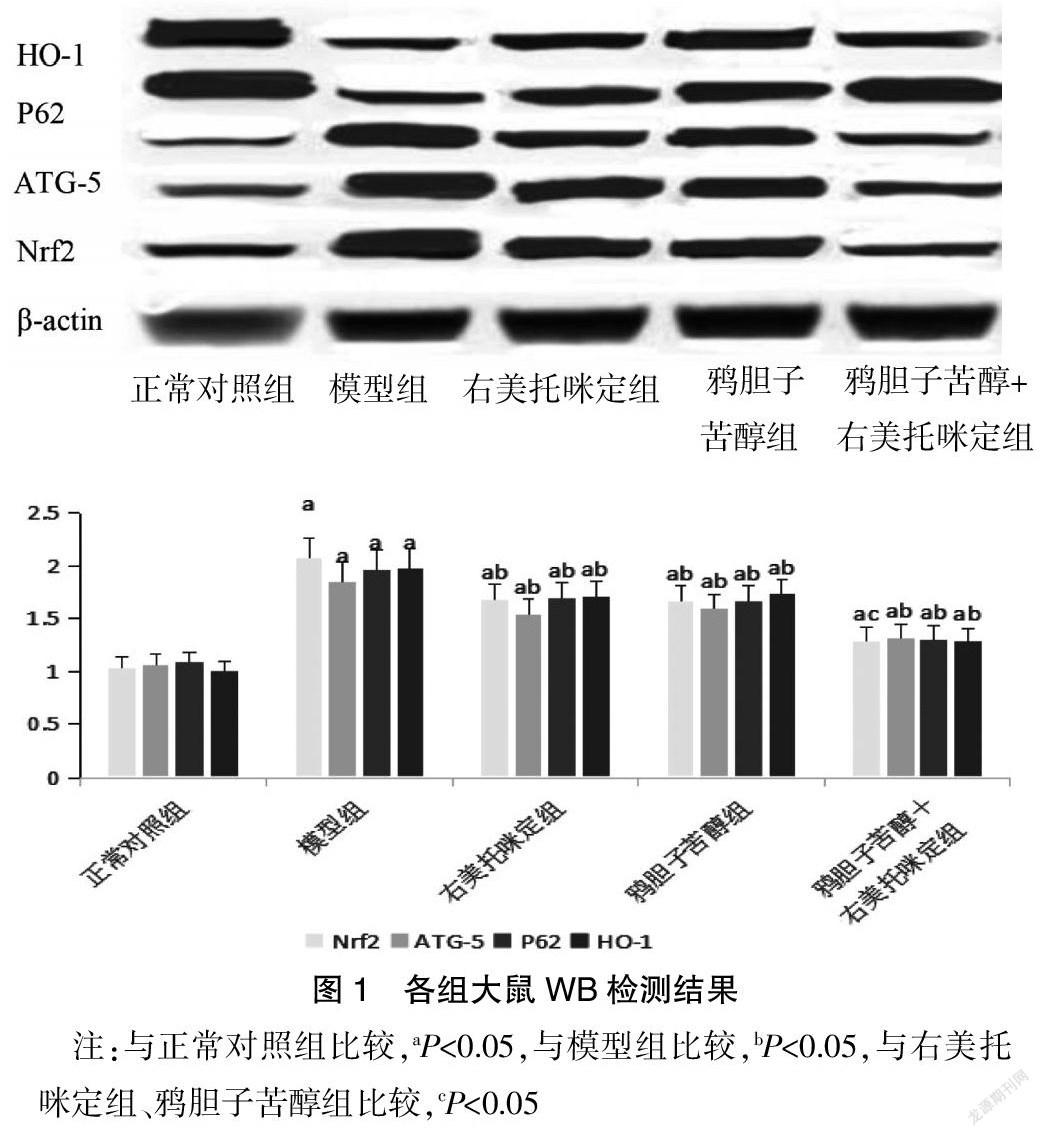
与正常对照组比较,模型组Nrf2,ATG-5和P62蛋白明显升高,HO-1明显下降,而右美托咪定组、鸦胆子苦醇组和鸦胆子苦醇+右美托咪定组Nrf2,ATG-5和P62蛋白明显降低,HO-1明显升高(P<0.05),且鸦胆子苦醇+右美托咪定组变化更为明显(P<0.05)。见图1。
3 讨论
急性肺损伤是脓毒症发生后最常见和最早出现的脏器损害,是由全身严重感染导致的炎症级联反应所致,大量炎症因子侵袭肺组织,造成弥漫性肺间质及肺泡水肿,增加了患者病死率[12-13]。因此,积极控制炎症反应和对症治疗在急性肺损伤治疗过程中显得极为关键。
本研究制备的急性肺损伤大鼠模型肺损伤评分,W/D 比值,IL-1β、IL-6和TNF-α水平均明显升高,同时具有明显的病理特征变化,肺泡组织结构遭受明显破坏,肺泡间隔亦明显增厚,肺泡及肺间质渗出红色物质,大量炎症细胞浸润,肺组织受到严重损伤,提示大鼠内毒急性肺损伤模型成功制备。右美托咪定是一种高选择性α2受体激动药,具有包括抗氧化、抗炎、免疫调节和抗致癌性在内的多种药理学活性,随着对其临床应用的深入研究,右美托咪定的器官保护尤其在肺损伤保护的作用愈发受到关注,既往研究显示,右美托咪定能够减轻 LPS 致大鼠急性肺损伤[14-15]。本研究显示,与模型组比较,右美托咪定组肺/体比值、肺损伤评分及IL-1β、IL-6和TNF-α水平明显降低,结合HE染色结果同时也说明右美托咪定对脓毒症大鼠急性肺损伤具有保护作用,本研究与以往研究类似,为了进一步确定其保护机制,本研究选取Nrf2/HO-1通路作为切入点。Nrf2 是属于 CNC家族,有6个不同的功能区,Nrf2 启动抗氧化应激作用的重要进程,Nrf2 通路下游的抗氧化物质就是HO-1,它在机体抗氧化應激、清除自由基中发挥关键作用[16-17]。近年来,有研究表明,Nrf2/HO-1通路参与调控自噬过程,而自噬在急性肺损伤过程中发挥重要作用[18],故本研究首次研究Nrf2/HO-1自噬通路是否参与右美托咪定在减轻急性肺损伤中的作用,在本研究中,模型大鼠肺组织Nrf2,ATG-5和P62蛋白高表达,而HO-1表达下调,表明肺损伤后自噬激活,但P62增高则提示自噬流不通畅,无法发挥正常生理功能[19-20]。给予Nrf2抑制剂鸦胆子苦醇后,ATG-5和P62蛋白表达相对于模型组来说明显减弱,提示给予Nrf2抑制剂后自噬程度减弱,自噬体的降解速度加快,使受损的自噬流恢复通畅,同时肺损伤评分降低,肺损伤组织病理改变程度减轻,炎症因子水平均显著下降,提示肺损伤症状明显减轻,更加证实Nrf2/HO-1-自噬通路在肺损伤中发挥重要作用,为了进一步证实Nrf2/HO-1通路调节的自噬过程是否参与右美托咪定的作用过程,故本研究实验设计上在Nrf2抑制剂基础上联用右美托咪定,观察其自噬蛋白表达和肺损伤变化情况,结果显示,联用右美托咪定后自噬蛋白的减弱趋势显著增强,与此同时肺损伤程度减轻程度更为明显,表明Nrf2抑制剂和右美托咪定对于通过Nrf2/HO-1通路调节自噬过程具有协同作用,能够更显著改善病情,进一步证实了Nrf2/HO-1自噬通路参与右美托咪定减轻肺损伤过程。
综上所述,右美托咪定可能通过抑制Nrf2/HO-1自噬通路减轻 LPS 诱导的大鼠急性肺损伤。在后续的研究工作中将会对右美托咪定调控急性肺损伤过程中自噬的作用靶点进行更加深入的研究,同时为脓毒症所致急性肺损伤的治疗方向提供更充实的理论依据。
[参考文献]
[1] 杨琦,曾迎楠,许永安.急性肺损伤发病与发展相关信号通路的研究进展[J].国际呼吸杂志,2020,40(24):1904-1909.
[2] 宋恒雅,黄杰,谢颂平.中性粒细胞在急性肺损伤中的作用的研究进展[J].广西医学,2020,42(10):114-116, 137.
[3] 韩晋峰. 线粒体DNA通过TLR-9放大急性肺损伤液体失衡及炎症反应的机制研究[D]. 长春:吉林大学,2019.
[4] Rodrigues NR,Batista,Jéssica Eduarda dos Santos,et al. Activation of p38MAPK and NRF2 signaling pathways in the toxicity induced by chlorpyrifos in Drosophila melanogaster:Protective effects of psidium guajava pom{í}fera L.(myrtaceae)hydroalcoholic extract[J]. Arabian Journal of Chemistry,2019,12(8):3490-3502.
[5] 巩红岩,郑芳,贾志杰,等. Nrf2/HO-1信号通路在远端缺血预处理减轻小鼠内毒素性急性肺损伤中的作用[J].中华麻醉学杂志,2018,38(2):245-249.
[6] 苏其利,王晓莉,谭小华,等. 花旗松素通过激活Nrf2/HO-1/HIF1α/Autophagy信号通路对H2O2所致H9C2细胞氧化应激保护作用的研究[J]. 生命科学研究,2017, 21(3):233-238.
[7] 刘疏柯,姜丽萍,刘贤,等. CGA衍生多肽CHR通过调控自噬流减轻脂多糖诱导的小鼠肺损伤[J]. 重庆医科大学学报,2020,45(6):731-736.
[8] 张勇. 右美托咪定调控miR-146a对脓毒症小鼠急性肺损伤的保护作用及机制[D]. 济南:山东大学,2019.
[9] 邢现良,朱妍梦,汤斌铨,等. 右美托咪定经门静脉预处理对肝部分切除术患者术中炎症反应和氧化应激的影响[J]. 临床麻醉学杂志,2020,36(4):317-321.
[10] Nonas S,Miller I,Kawkitinarong K,et al. Oxidized phospholipids reduce vascular leak and inflammation in rat model of acute lung injury[J]. Am J Respir Crit Care Med,2006,173:1130-1138.
[11] Murakami K,McGuire R,Cox RA,et al. Heparin nebulization attenuates acute lung injury in sepsis following smoke in-halation in sheep[J]. Shock,2002,18(3):236-241.
[12] Michael A Matthay,Rachel L Zemans,Guy A Zimmerman,et al. Acute respiratory distress syndrome[J].Nat Rev Dis Primers,2019,5(1):18.
[13] Wang YC,Liu QX,Zheng Q,et al. Dihydromyricetin alleviates sepsis-induced acute lung injury through inhibiting NLRP3 inflammasome-dependent pyroptosis in mice model[J]. Inflammation,2019,42(4):1301-1310.
[14] 孟志鵬,刘静,胡四平,等. 盐酸戊乙奎醚与右美托咪定在内毒素致大鼠急性肺损伤的保护性作用比较[J]. 重庆医学,2019,48(15):27-30.
[15] 李灵丰,吴晓静,孔倩,等. 右美托咪定对胸部撞击-失血性休克复苏致大鼠急性肺损伤时NLRP3炎症小体的影响[J]. 中华麻醉学杂志,2019,39(6):754-757.
[16] 李孟心,张枫惠,韩高链,等. Nrf2/HO-1信号通路在人诱导性多能干细胞氧化应激中的作用[J]. 中国生物化学与分子生物学报,2019,35(7):107-115.
[17] 林群,郭依清,林小华,等. Nrf2/HO-1信号通路在骨髓间充质干细胞减轻大鼠内毒素性急性肺损伤中的作用[J]. 中华麻醉学杂志,2019,39(3):381-384.
[18] 王甜甜,陈淳媛,杨雷,等. Nrf2/HO-1信号轴在氧化应激性疾病中的机制[J]. 中南大学学报(医学版),2019, 44(1):80-86.
[19] Morel E,Mehrpour M,Botti J,et al. Autophagy:A druggable process[J]. Annu Rev Pharmacol Toxicol,2017,57(1):375-398.
[20] Liu H,Zhou K. Lipoxin A4 receptor agonist BML-111 induces autophagy in alveolar macrophages and protects from acute lung injury by activating MAPK signaling[J]. Respir Res,2018,19(1):243.
(收稿日期:2021-05-17)
猜你喜欢咪定美托通路右美托咪定对老年人术后认知功能的影响机制研究人人健康(2020年7期)2020-09-02右美托咪啶用于腹部手术全身麻醉效果的相关思考科学导报·学术(2020年10期)2020-03-30老年高血压患者行胸腔镜手术治疗采用右美托咪定复合地佐辛的分析人人健康(2019年10期)2019-10-14洽洽食品布局无界零售 与京东新通路达成战略合作中国信息化周报(2019年8期)2019-03-27美托洛尔:降压又护心家庭医药(2017年8期)2017-08-18右美托咪定对术后失眠的疗效观察中国实用医药(2016年24期)2016-10-17胃肠道恶性肿瘤术后应用右美托咪定和舒芬太尼自控镇痛效果评价中国民族民间医药·上半月(2013年1期)2013-11-01关联通路,低成本破解渠道障碍销售与管理(2006年9期)2006-09-17