洪莹 毛建越 赵树兰 多立安

摘要:为探讨不同浓度氧化石墨烯(GO)对多年生黑麦草生长、生理及光合特征的影响,该文采用盆栽试验,在土壤中添加0、10、20、30、40、50 mg·g1GO进行多年生黑麦草培养,并测定植物生长指标、光合色素含量、保护酶活性、丙二醛(MDA)含量、叶片质膜透性、可溶性蛋白含量和光合参数。结果表明:(1)10、20 mg·g1GO处理对多年生黑麦草生长无显著影响;30~50 mg·g1GO处理对多年生黑麦草生长具有抑制作用,在50 mg·g1 GO浓度下多年生黑麦草株高和生物量均最小,较对照分别降低了16.8%和27.1%。(2)当GO浓度达到30 mg·g1时,总叶绿素和类胡萝卜素的含量显著降低,在50 mg·g1 GO处理时达到最低。(3)高浓度的GO处理(40、50 mg·g1)虽降低了多年生黑麦草的叶片净光合速率(Pn)、气孔导度(Gs)和蒸腾速率(Tr),但增加了胞间CO2浓度(Ci)。(4)低浓度的GO处理(10、20 mg·g1)对保护酶活性、丙二醛含量、叶片质膜透性和可溶性蛋白含量无显著影响,而高浓度的GO处理(40、50 mg·g1)使多年生黑麦草的超氧化物歧化酶(SOD)、過氧化物酶(POD)、过氧化氢酶(CAT)活性、MDA含量和叶片质膜透性显著升高,而可溶性蛋白含量则下降,植物叶片受到损伤。综上认为,高浓度的GO处理(40、50 mg·g1)会对多年生黑麦草产生氧化胁迫,从而抑制了植物的生长。
关键词:
多年生黑麦草, 氧化石墨烯, 逆境生理, 氧化胁迫, 光合参数
中图分类号:Q945
文献标识码:A
文章编号:10003142(2022)05088608
Effects of graphene oxide on stress physiological and
photosynthetic characteristics of Lolium perenne
Abstract:In order to explore the effects of graphene oxide (GO) with different concentrations on the growth, physiological and photosynthetic characteristics of perennial ryegrass (Lolium perenne) seedlings, a pot experiment was conducted by culturing perennial ryegrass in soil with treatments of GO in 0, 10, 20, 30, 40, 50 mg·g1GO respectively. Parameters including plant growth, photosynthetic pigment contents, protective enzyme activity, malondialdehyde (MDA) content, leaf membrane permeability, soluble protein content as well as photosynthetic parameters were measured. The results were as follows:
(1) No significant effects were detected on the growth of perennial ryegrass under 10, 20 mg·g1 GO treatments, however, 30-50 mg·g1 GO inhibited the perennial ryegrass growth. Under the 50 mg·g1 GO treatment, plant height and biomass of perennial ryegrass were the minimum in value, which were decreased by 16.8% and 27.1% compared with the control. (2) The contents of total chlorophyll and carotenoid decreased significantly when the concentration of GO reached 30 mg·g1, and the lowest value was found in 50 mg·g1 GO treatment. (3) High concentrations of GO (40, 50 mg·g1) decreased net photosynthetic rate (Pn), stomatal conductance (Gs) and transpiration rate (Tr), but increased the intercellular CO2 concentration (Ci). (4) Low concentrations of GO (10, 20 mg·g1) had no significant effects on protective enzyme activity, MDA content, plasma membrane permeability and soluble protein content, while high concentrations of GO (40, 50 mg·g1) significantly increased superoxide dismutase (SOD), peroxidase (POD), catalase (CAT) activities, MDA content and plasma membrane permeability, decreased soluble protein content and damaged plant leaves. All the above results indicate that the addition of GO with high concentrations (40, 50 mg·g1) constitutes a stress on the growth of perennial ryegrass, thus inhibited plant growth.0C587D43-4708-4A27-8875-DD0D965A5D18
Key words:
perennial ryegrass (Lolium perenne), graphene oxide (GO), stress physiology, oxidative stress, photosynthetic parameters
作为石墨烯的一种重要衍生物,氧化石墨烯(GO)含有大量的含氧活性基团,如羧基、羟基与环氧基团等(Martín et al., 2019)。由于GO具有良好的热、电传导和亲水性,因此使其在很多领域都具有应用价值(Chen Z et al., 2020),如在污染物吸附、能源发展和生物医学等方面。然而,随着纳米新技术的快速发展,纳米材料使用量不断增加,GO等纳米材料会直接或间接被排放到环境中,给生物体和环境带来难以预测的安全隐患(Fadeel et al., 2018)。
近年来,GO对植物逆境生理及光合特征的影响已成为国内外学者研究的热点。有研究发现,GO对植物有着正面的积极作用,低剂量可以促进菠菜和韭菜的发芽和生长(He et al., 2018);GO高的比表面積使其具有很强的吸附性,在低浓度下可以降低Cd2+对玉米生长的抑制作用(Yin et al., 2018)。但是,更多的研究发现,GO对植物具有负面影响(Chen M et al., 2018;Du et al., 2020;Weng et al., 2020)。GO具有大的比表面积,可使细胞活性氧(ROS)增加,攻击DNA、蛋白质和细胞膜,导致细胞损伤进而产生毒性(Hu et al., 2014a;Jia et al., 2019);GO具有尖锐的边缘,通过与细胞的相互碰撞,会造成细胞表面受损(Sengupta et al., 2019)。Hao等(2018)研究发现,浓度为50、500 mg·kg1的还原氧化石墨烯(rGO)均显著降低了水稻地上部干重。GO对植物的影响随着其剂量、尺寸、接触时间和植物种类的不同而不同。由于植物在生态系统的组成成分中起着主导作用,因此研究GO对植物生长、生理和光合特征影响具有重要意义。
目前,关于GO对陆生植物影响研究常常采用水培试验,土培盆栽试验鲜有报道(Hao et al., 2018),而后者能够更好地模拟土壤中输入GO对植物生长的影响。鉴于此,本研究选择多年生黑麦草作为试验植物,将不同浓度GO添加到盆栽土壤中,以探讨GO对多年生黑麦草生长和生理光合特性的影响,以期为GO的风险评价及安全应用提供理论依据。
1 材料与方法
1.1 供试材料
多年生黑麦草种子购自宿迁卉艺种业有限公司,品种名为爱森特(Accent)。试验用土壤为天津师范大学校园内0~20 cm的表层土壤。其基本性质如下:pH 7.45,含盐量0.1%,有机质含量4.68%,碱解氮137.42 mg·kg1,速效钾71.63 mg·kg1,有效磷22.03 mg·kg1,饱和含水量0.56 mL·g1,容重0.87 g·cm3。GO购自苏州恒球石墨烯科技有限公司,为褐黄色粉末,平均厚度为3.4~7 nm,片层直径为10~50 μm,比表面积为100~300 m2·g1。
1.2 植物培养
植物培养于2019年7月1日进行,将多年生黑麦草种子放于铺有蒸馏水润湿托盘中,于室温下进行催芽处理,待种子萌发后转移到添加不同GO浓度的土壤中进行培养,每盆播种100粒。
首先,将一定量的GO(4.2、8.4、12.6、16.8、21 g)分别加入到420 g未灭菌处理的土壤中,用小抹刀充分混合均匀20 min;然后,装入塑料花盆(直径7 cm、高8 cm)中,得到浓度分别为10、20、30、40、50 mg·g1GO处理,以不添加GO(0 mg·g1)为对照,每个处理4次重复。植物在室内培养,期间保证水分供应,使土壤含水量保持在最大持水量的60%。光照为透入室内的自然光(623~33 020 lx)。在培养过程中,定期调换花盆位置,以确保每个花盆处于一致的光照条件下。培养期间的环境温度为20~27 ℃,相对湿度为17%~54%;培养时间40 d,在多年生黑麦草的分蘖期进行指标测定。
1.3 指标测定
1.3.1 生长指标的测定株高的测定,即播种40 d测量多年生黑麦草株高,从盆中随机选取5株植株,取其平均值。地上生物量的测定,即在播种40 d时,将多年生黑麦草地上部分齐地面刈割,于108 ℃下杀青20 min,80 ℃烘干至恒质量,称重。
1.3.2 叶绿素与类胡萝卜素含量的测定取0.2 g新鲜叶片,剪成1~2 mm碎片,浸泡于20 mL丙酮、乙醇体积比为1∶1的提取溶液中,避光浸提24 h,至叶片完全脱色。将1 mL浸提液与4 mL提取液稀释后,在波长663、645、470 nm下测量吸光度,并计算叶绿素与类胡萝卜素含量。
1.3.3 保护酶活性和丙二醛含量的测定酶提取液的制备,即取0.5 g新鲜叶片,加入3 mL提取液(由pH 7.0、50 mmol·L1磷酸缓冲液和1 mmol·L1EDTA配制而成)和石英砂,研磨完全后将研磨液倒入离心管中,在4 ℃,10 000 r·min1下离心20 min。取上清液并放置在4 ℃冰箱中,待测。过氧化物酶(POD)活性采用愈创木酚法测定(Omran et al., 1980);过氧化氢酶(CAT)活性采用紫外分光光度法测定(Singh et al., 2010);超氧化物歧化酶(SOD)活性采用比色法测定(Wang et al., 2014);丙二醛(MDA)含量采用硫代巴比妥酸法测定(Sundar et al., 2004)。
1.3.4 叶片质膜透性和可溶性蛋白含量测定叶片质膜透性采用相对电导率法测定(Guo et al., 2019)。称取0.2 g叶片,剪碎后置于10 mL去离子水的试管中,室温下浸泡12 h,用电导率仪测定浸提液电导率(R1)。然后沸水浴30 min,冷却至室温后摇匀,测定浸提液电导率(R2)。按下式计算相对电导率(REC,%):0C587D43-4708-4A27-8875-DD0D965A5D18
REC(%)=R1/R2×100。
可溶性蛋白的测量采用考马斯亮蓝法(Zou et al., 2020) 。将0.2 g新鲜叶片放入有2 mL蒸馏水的研钵中,研磨成匀浆后,将其置于离心管中,放置0.5~1.0 h充分提取,在4 000 r·min1条件下离心20 min。将上清液转移至10 mL刻度试管中,并用蒸馏水定容,为待测样品的提取液。吸取1 mL提取液放入10 mL试管中,再加入5 mL考马斯亮蓝G250溶液,充分混合,静置后在波长595 nm下测定吸光值,并计算蛋白质含量。
1.3.5 光合参数的测定光合参数的测定于播种后的35 d进行。9:00—11:30用LI6400便携式光合作用系统(LI6400XT,Lincoln,Nebraska)对第二片完全展开的叶子(从上到下)进行测量。主要参数包括净光合速率(Pn,μmol CO2· m2·s1),气孔导度(Gs,μmol H2O· m2·s1),蒸腾速率(Tr,mmol H2O·m1·s1)和胞间CO2浓度(Ci,μmol CO2·s1)。光照设定为1 000 μmol·m2·s1,温度为28~30 ℃,CO2浓度为360 μmol·mol1。
1.4 数据处理
所得数据以平均值±标准差表示。采用SPSS 20.0软件进行单因素方差分析不同GO浓度处理间的差异,并采用Tukey法,在P=0.05水平进行数据差异显著性检验。
2 结果与分析
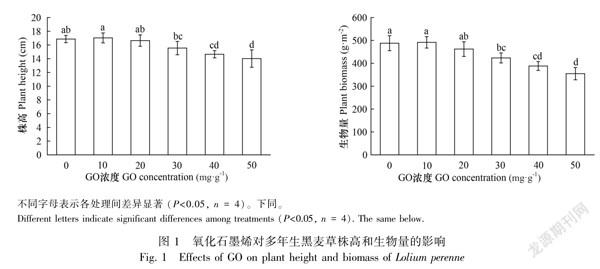
2.1 氧化石墨烯对多年生黑麦草株高和生物量的影响
GO对多年生黑麦草株高和生物量的影响如图1所示。从图1可以看出,生长40 d时,10 mg·g1 GO处理株高为最大值,且与对照差异不显著(P>0.05);GO浓度大于10 mg·g1时,株高随GO浓度的增大呈下降趋势;浓度超过30 mg·g1时,株高则显著低于对照组(P<0.05),50 mg·g1 GO处理株高为最低。与株高的结果相类似,10、20 mg·g1GO处理对生物量的影响不大,但GO浓度达到30 mg·g1时,则显著抑制了生物量的积累(P<0.05),且抑制作用随GO浓度增大而增加。
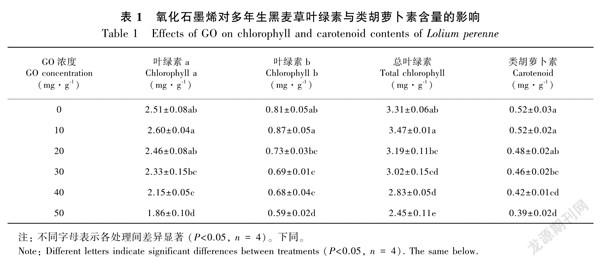
2.2 氧化石墨烯对多年生黑麦草叶绿素与类胡萝卜素含量的影响
如表1所示,10 mg·g1 GO处理多年生黑麦草叶绿素a、叶绿素b、总叶绿素与类胡萝卜素含量
为最高,且与对照差异不显著(P>0.05)。GO浓度超过20 mg·g1时,叶绿素b、总叶绿素与类胡萝卜素含量均显著低于对照组(P<0.05);浓度超过30 mg·g1时,叶绿素a含量显著低于对照组(P<0.05);之后,随着GO浓度的增大,叶绿素与类胡萝卜素的含量呈显著下降趋势。
2.3 氧化石墨烯对多年生黑麦草保护酶活性和MDA含量的影响
GO对多年生黑麦草保护酶活性和MDA含量有显著影响。从图2可以看出,与对照相比,10、20 mg·g1 GO处理对POD活性无显著影响(P>0.05),随着GO浓度增加表现出升高趋势;浓度超过20 mg·g1的处理,POD活性显著高于对照组(P<0.05);50 mg·g1 GO处理组POD活性最大,较对照增加45.59%。10 mg·g1 GO處理,SOD活性较对照组无明显差异(P>0.05),GO浓度超过10 mg·g1的处理,SOD活性均显著高于对照(P<0.05)。CAT活性随着GO浓度的增加表现出先增加后降低的趋势,除10 mg·g1处理与对照差异不显著(P>0.05)外,其他GO处理CAT活性均显著高于对照(P<0.05),在30 mg·g1GO处理下CAT活性最大,较对照增加了90.72%。
与对照相比,10、20 mg·g1 GO处理没有显著增加MDA含量(P>0.05),但GO浓度达到30 mg·g1时,MDA含量显著增加(P<0.05),在50 mg·g1处理达到最大,较对照增加了37.33%。
2.4 氧化石墨烯对多年生黑麦草叶片质膜透性和可溶性蛋白含量的影响
GO对多年生黑麦草叶片质膜透性和可溶性蛋白含量的影响如图3所示。从图3可以看出,10、20 mg·g1 GO处理多年生黑麦草叶片相对电导率与对照均无明显差异(P>0.05),随着氧化石墨烯浓度的增加表现出升高趋势;超过20 mg·g1的GO处理显著高于对照组(P<0.05),50 mg·g1处理叶片质膜透性最大,较对照增加了28.49%。
多年生黑麦草可溶性蛋白含量随着GO浓度的增加表现出降低趋势,大于20 mg·g1的GO处理显著低于对照(P<0.05);50 mg·g1 GO处理最小,与对照相比,降低了16.23%。
2.5 氧化石墨烯对多年生黑麦草光合参数的影响
如表2所示,10 mg·g1 GO处理组多年生黑麦草的净光合速率、气孔导度与蒸腾速率均为最大值,胞间二氧化碳浓度为最小值,但与对照组没有显著性差异(P>0.05)。与对照相比,GO浓度高于20 mg·g1时,气孔导度与蒸腾速率受到抑制;浓度高于30 mg·g1时,多年生黑麦草净光合速率受到明显抑制(P<0.05),胞间二氧化碳浓度显著增加(P<0.05)。
3讨论与结论
植物株高与生物量是反映植物地上生长状况的重要指标。本研究中,10、20 mg·g1 GO对多年生黑麦草的株高与生物量没有显著影响;GO浓度高于30 mg·g1时,株高与生物量受到显著抑制,且随着GO浓度增大抑制作用增加。Begum等(2011)发现,500~2 000 mg·L1的石墨烯对甘蓝(Brassica oleracea )、番茄(Solanum lycopersicum)和红菠菜(Senecio fuluipes)的幼苗苗长、苗重和叶面积均有明显的抑制作用,且随着石墨烯剂量的增加抑制作用更加显著。Chen LY等 (2018)的研究表明低浓度GO (0.04 g·L1)下裸燕麦 (Avena sativa)0C587D43-4708-4A27-8875-DD0D965A5D18
地上部分干重较对照增加,而在高浓度GO(0.2 g·L1)时则显著减少,与本研究结果相一致。可能的原因是GO能够进入或附着于植物细胞,阻碍植物细胞对营养物质的吸收而抑制其生长;此外,GO还会影响植物代谢途径,从而导致生物产量的降低(Hu et al., 2014b)。
叶绿素是植物光合作用中的主要色素,其含量可以反映植物光合作用的强弱与生长情况(Zhang et al., 2018)。本研究发现,GO浓度达到30 mg·g1时,多年生黑麦草叶绿素及类胡萝卜素的含量均显著下降。Gao等(2019)研究发现,浓度大于20 mg·L1的GO明显降低小麦(Triticum aestivum)叶绿素含量;Hu等(2014b)研究发现,GO能在小麦细胞内积累,破坏叶绿体结构,可以推测GO在黑麦草细胞内积累,破坏叶绿体结构,抑制叶绿素的合成,从而导致其含量降低。
SOD是生物体内重要的抗氧化酶,能清除生物体内O2-自由基。本研究中,GO处理使多年生黑麦草SOD活性增加,它的诱导说明植物体内产生了大量活性氧;GO处理使POD和CAT的活性有所增加,它们能够有效清除植物体内产生的H2O2。MDA含量可间接反映植物细胞膜脂过氧化程度,其含量越高,表明膜透性越大,膜脂过氧化程度越高(Chen HH et al., 2020)。相对电导率既可反映细胞外渗物质的多少,也可作为膜受损程度的辨别指标(Guo et al., 2019)。本研究中,GO处理MDA含量和相对电导率升高,表明多年生黑麦草受到了氧化胁迫。Chen等(2017)利用13C标记GO处理小麦发现,小麦CAT、POD酶活性升高,MDA含量增加。Vochita等(2019)的研究发现,500~2 000 mg·L1 GO处理小麦时,表现出剂量效应,500 mg·L1 GO浓度时SOD、POD、CAT的活性达到最大值,对小麦产生氧化胁迫;在1 000、2 000 mg·L1 GO浓度,抑制了酶活性,加剧氧化损伤。因为GO的主要毒性机制是通过产生大量的ROS而诱导氧化胁迫,所以当抗氧化酶不足以清除ROS时,就会攻击DNA、蛋白质和细胞膜,促使膜质过氧化、MDA含量增加,最终导致细胞死亡(Tan et al.,2009;胡俊杰等,2017)。
可溶性蛋白是重要的渗透调节物质和营养物质,在植物代谢调节中具有重要作用。本研究结果表明,浓度大于30 mg·g1GO处理可溶性蛋白含量显著降低,袁刚强等(2015)的研究也发现,水稻(Oryza sativa)可溶性蛋白含量随单壁碳纳米管剂量的增加而下降。可能的原因是GO阻碍了多年生黑麦草根系对矿质离子的吸收,蛋白质合成缺少所需的元素P、S、Fe等(黄溦溦等,2012)。
光合作用将CO2转变成有机物积累在植物体内,是植物生长发育的重要生理过程(范七君等,2020)。本研究中,净光合速率、蒸腾速率、气孔导度与叶绿素的变化趋势基本一致,GO浓度大于30 mg·g1时,植物气孔导度显著减小,蒸腾速率和净光合速率显著降低。Zhang等(2016)的研究发现,石墨烯降低了小麦的叶绿素含量,同时抑制光系统Ⅱ(PS Ⅱ)活性。Chen等(2019)发现,积累在豌豆(Pisum sativum)根部的还原GO转移到叶片,由于产生氧化胁迫,因此破坏供体侧的含氧復合物而直接抑制PS Ⅱ的活性。净光合速率的下降说明GO阻碍了CO2的固定,生物量减少;蒸腾速率和气孔导度降低表明水分和其他物质的传输受到影响(Chen LY et al., 2018)。高浓度GO处理下多年生黑麦草叶绿素含量减少、净光合速率降低和生物量减少相一致,说明GO对幼苗生长产生胁迫,使叶绿素合成受阻,影响植物光合作用,进而抑制植物生长。
综上所述,低浓度的GO对多年生黑麦草的生长、光合、保护酶活性、MDA含量、叶片质膜透性和可溶性蛋白含量没有显著影响,40、50 mg·g1GO处理使保护酶活性、MDA含量和叶片质膜透性升高,而可溶性蛋白含量却下降,从而对多年生黑麦草产生氧化胁迫,使植物叶片受到损伤。因此,植物可以通过提高保护酶活性,来抵御GO的胁迫。
参考文献:
BEGUM P, IKHTIARIA R, FUGETSU B, 2011.Graphene phytotoxicity in the seedling stage of cabbage, tomato, red spinach, and lettuce [J]. Carbon, 49:
3907-3919.
CHEN HH, JIA YM, XU H, et al., 2020. Ammonium nutrition inhibits plant growth and nitrogen uptake in citrus seedlings [J]. Sci Hortic, 272:
109526.
CHEN LY, WANG CL, YANG SN, et al., 2019. Chemical reduction of graphene enhances in vivo translocation and photosynthetic inhibition in pea plants [J].Environ Sci:
Nano, 6(4):
1077-1088.
CHEN LY, YANG SN, LIU Y, et al., 2018. Toxicity of graphene oxide to naked oats (Avena sativa L.) in hydroponic and soil cultures [J].RSC Adv, 8(28):
15336-15343.
CHEN LY, WANG CL, LI HL, et al., 2017. Bioaccumulation and toxicity of 13Cskeleton labeled graphene oxide in wheat [J].Environ Sci Technol, 51(17):
10146-10153.0C587D43-4708-4A27-8875-DD0D965A5D18
CHEN M, ZHOU S, ZHU Y, et al., 2018. Toxicity of carbon nanomaterials to plants, animals and microbes:
Recent progress from 2015present [J].Chemosphere, 206:
255-264.
CHEN Z, YU C, KHAN IA, et al., 2020. Toxic effects of differentsized graphene oxide particles on zebrafish embryonic development [J].Ecotox Environ Safe, 197:
110608.
DU JJ, WANG T, ZHOU QX, et al., 2020.Graphene oxide enters the rice roots and disturbs the endophytic bacterial communities [J].Ecotox Environ Safe, 192:
110304.
FADEEL B, BUSSY C, MERINO S, et al., 2018. Safety assessment of graphenebased materials:
focus on human health and the environment [J].ACS Nano, 12(11):
10582-10620.
FAN QJ, CHEN CW, DENG CL, et al., 2020. Influence of canopy filmcovering on photosynthesis and fruits qualities in kumquat [J]. Guihaia, 40(7):
1046-1053.[范七君, 陈传武, 邓崇岭, 等, 2020. 树冠覆膜对金柑光合作用及果实品质的影响 [J].广西植物, 40(7):
1046-1053.]
GAO ML, YANG YJ, SONG ZG, 2019. Effects of graphene oxide on cadmium uptake and photosynthesis performance in wheat seedlings [J].Ecotox Environ Safe, 173:
165-173.
GUO H, GONG YB, BAO AK, 2019. Comperhensive assessment of drought resistance in seedlings of five alfalfa (Medicago sativa L.) cultivars [J].Appl Ecol Environ Res, 17(6):
13253-13261.
HAO Y, MA CX, ZHANG ZT, et al., 2018.Carbon nanomaterials alter plant physiology and soil bacterial community composition in a ricesoilbacterial ecosystem [J].Environ Poll, 232:
123-136.
HE YJ, HU RR, ZHONG YJ, et al., 2018. Graphene oxide as a water transporter promoting germination of plants in soil [J].Nano Res, 11(4):
1928-1937.
HUANG WW, HU TX, ZHANG NN, et al., 2012. Effects of leaf litter of Cinnamomum septentrionale on growth and resistance physiology of Brassica rapa in the decomposition process of litter [J].Acta Ecol Sin, 32(12):
3883-3891.[黃溦溦, 胡庭兴, 张念念, 等, 2012. 银木凋落叶腐解过程对小白菜生长和抗性生理的影响 [J].生态学报, 32(12):
3883-3891.]
HU JJ, LAO ZL, WU KM, et al., 2017. Research progress in environmental behavior and toxicity of graphene oxide [J].Ecol Environ Sci, 26(12):
2169-2176.[胡俊杰, 劳志朗, 吴康铭, 等, 2017. 氧化石墨烯的环境行为和毒性效应研究进展 [J].生态环境学报, 26(12):
2169-2176.]
HU XG, LU K, MU L, et al., 2014a. Interactions between graphene oxide and plant cells:
Regulation of cell morphology, uptake, organelle damage, oxidative effects and metabolic disorders [J].Carbon, 80:
665-676.
HU XG, KANG J, LU KC, et al., 2014b.Graphene oxide amplifies the phytotoxicity of arsenic in wheat [J].Sci Rep, 4(1):
6122.0C587D43-4708-4A27-8875-DD0D965A5D18
JIA PP, SUN T, JUNAID M, et al., 2019.Nanotoxicity of different sizes of graphene (G) and graphene oxide (GO) in vitro and in vivo [J].Environ Poll, 247:
595-606.
MARTN C, KOSTARELOS K, PRATO M, et al., 2019. Biocompatibility and biodegradability of 2D materials:
graphene and beyond [J].Chem Commun, 55(39):
5540-5546.
OMRAN RG, 1980. Peroxide levels and the activities of catalase, peroxidase, and indoleacetic acid oxidase during and after chilling cucumber seedlings [J].Plant Physiol, 65(2):
407-408.
SENGUPTA I, BHATTACHARYA P, TALUKDAR M, et al., 2019. Bactericidal effect of graphene oxide and reduced graphene oxide:
influence of shape of bacteria [J].Colloid Interfac Sci Comm, 28:
60-68.
SINGH BK, SHARMA SR, SINGH B, 2010. Antioxidant enzymes in cabbage:
variability and inheritance of superoxide dismutase, peroxidase and catalase [J].Sci Hortic, 124(1):
9-13.
SUNDAR D, PERIANAYAGUY B, REDDY AR, 2004. Localization of antioxidant enzymes in the cellular compartments of sorghum leaves [J].Plant Growth Regul, 44(2):
157-163.
TAN XM, LIN C, FUGETSU B, 2009. Studies on toxicity of multiwalled carbon nanotubes on suspension rice cells [J].Carbon, 47(15):
3479-3487.
VOCHITA G, OPRICA L, GHERGHEL D, et al., 2019.Graphene oxide effects in early ontogenetic stages of Triticum aestivum L. seedlings [J].Ecotox Environ Safe, 181:
345-352.
WANG YF, PAN FB, WANG GS, et al., 2014. Effects of biochar on photosynthesis and antioxidative system of Malus hupehensis Rehd. seedlings under replant conditions [J].Sci Hortic, 175(1):
9-15.
WENG YN, YOU Y, LU Q, et al., 2020.Graphene oxide exposure suppresses nitrate uptake by roots of wheat seedlings [J].Environ Poll, 262:
114224.
YIN LY, WANG Z, WANG SG, et al., 2018. Effects of graphene oxide and/or Cd2+ on seed germination, seedling growth, and uptake to Cd2+ in solution culture [J].Water Air Soil Poll, 229(5):
151.
YUAN GQ, GONG JL, ZENG GM, 2015.Phytotoxicity of singlewalled carbon nanotubes to rice seedling (Oryza sativa L.) [J].Acta Sci Circumst, 35(12):
4143-4149.[袁剛强, 龚继来, 曾光明, 2015. 单壁碳纳米管材料对水稻幼苗的毒性效应 [J].环境科学学报, 35(12):
4143-4149.]
ZHANG P, ZHANG RR, FANG XZ, et al., 2016. Toxic effects of graphene on the growth and nutritional levels of wheat (Triticum aestivum L.):
shortand longterm exposure studies [J].J Hazard Mat, 317:
543-551.
ZHANG XH, LIU YH, LIU Q, et al., 2018. Nitric oxide is involved inabscisic acidinduced photosynthesis and antioxidant system of tall fescue seedlings response to lowlight stress [J].Environ Exp Bot, 155:
226-238.
ZOU ZK, WANG YQ, HUANG JL, et al., 2020. A study on the mixture repairing effect of biochar and nano iron oxide on toxicity of Cd toward muskmelon [J].Environ Poll, 266:
115371.
(责任编辑蒋巧媛)
收稿日期:2021-02-03
基金项目:国家自然科学基金(31870484) [Supported by National Natural Science Foundation of China (31870484) ]。
第一作者:
洪莹(1995-),硕士研究生,主要从事植物生理生态学研究,(Email)904673307@qq.com。
通信作者:多立安,博士,教授,博士研究生导师,主要从事植物生理生态学研究,(Email)duolian_tjnu@163.com。0C587D43-4708-4A27-8875-DD0D965A5D18