殷娜 宋娜丽 普晓佳 顾茜兰 杨海浩 万春平 祁燕 李小丝 郑喜
摘要:藥用植物内生真菌能产生与宿主相同或相似的活性物质,民族药马利筋生物活性广泛。为获得马利筋活性内生真菌资源,该研究基于“民族药-内生真菌-活性成分”的思路,考察了168株马利筋内生真菌代谢产物的生物活性,并分别采用SRB法、Griess法、PNPG法和DPPH法对内生真菌发酵液乙酸乙酯提取物进行抗肿瘤、抗炎、α葡萄糖苷酶抑制和抗氧化等生物活性测定,对活性菌株进行ITS菌种鉴定。结果表明:(1)所筛选的168株内生真菌中有22株表现出不同程度的生物活性。其中,9株内生真菌具有显著抗肿瘤活性,其IC50值在0.1~40μg·mL1之间;菌株MJF53在2.5μg·mL1时对LPS诱导的Raw264.7释放的NO和IL1β均具有明显的抑制作用;7株内生真菌表现出不同程度的α葡萄糖苷酶抑制活性,其IC50值在1.0~4.0mg·mL1之间,其中MYF16和MYF55对α葡萄糖苷酶抑制活性接近阿卡波糖;19株内生真菌具有不同程度的DPPH自由基清除活性,其中菌株MYF9、MYF19和MJF84表现出中等强度的抗氧化活性,IC50值分别为13.562、17.776、12.395μg·mL1。(2)ITS菌株鉴定发现,22株活性菌株分属于链格孢属(Alternariasp.)、刺盘孢属(Colletotrichumsp.)、镰刀菌属(Fusariumsp.)、间座壳属(Diaporthesp.)、踝节菌属(Talaromycessp.)和新壳梭孢属(Neofusicoccumsp.)等不同属。研究结果认为,马利筋内生真菌的生物活性具有多样性,可为从马利筋内生真菌中挖掘潜在新型天然抗肿瘤、抗炎、降糖和抗氧化活性化合物奠定基础。
关键词:马利筋,内生真菌,抗肿瘤,抗炎,α葡萄糖苷酶抑制剂,DPPH自由基,ITS
中图分类号:Q946
文献标识码:A
文章编号:10003142(2022)05078109
Biologicalactivitiesofendophyticfungi
fromAsclepiascurassavica
Abstract:Endophyticfungiinmedicinalplantshavethecapacitytoproducebioactivecompoundswhosefeatureshavegreatidentityorsimilaritywiththephytohosts.SinceAsclepiascurassavicahasbeenknowntopossessabroadrangeofbiologicalactivities,wesoughttoobtaintheactiveendophyticfungifromthisplant.Weperformedthestudyfollowedtheideaof“ethnicdrug-endophyticfungi-activeingredients”,andthereafterweexaminedthebioactivitiesoffungalmetabolitesfrom168strainsofendophyticfungiisolatedfromA.curassavica.Toevaluatethebiologicalactivitiesofantitumor,antiinflammatory,antiαglucosidaseandantioxidantinthesefungi,theethylacetateextractsfromfermentationbrothofendophyticfungiwerefirstdeterminedusingthemethodsofSRB,Griess,PNPGandDPPH,respectively.Furthermore,weidentifiedthebioactivefungalstrainswithconservedITSsequencing.Theresultswereasfollows:(1)Atotalof22in168isolatedstrainshadvariablebiologicalactivities.NinestrainshadobviousantitumoreffectwiththeIC50valuesof0.1-40μg·mL1.Further,thestrainMJF53displayedprominentinhibitoryeffectsonthereleaseofbothNOandIL1βinRaw264.7celllinebyLPSinductionundertheconcentrationof2.5μg·mL1.ThereweresevenstrainsshowingαglucosidaseinhibitoryactivitywiththeIC50valuesrangingfrom1.0to4.0mg·mL1,especially,theinhibitoryactivitiesofMYF16andMYF55wereclosetoacarbose;19endophyticfungihaddifferentdegreesofDPPHfreeradicalscavengingactivities,amongwhichMYF9,MYF19andMJF84showedmoderateantioxidantactivitieswithIC50valuesof13.562,17.776and12.395μg·mL1respectively.(2)TheITSidentificationshowedthatthe22activestrainsweremainlydistributeinsixgenera:Alternariasp.,Colletotrichumsp.,Fusariumsp.,Diaporthesp.,Talaromycessp.andNeofusicoccumsp.ThisstudyindicatesthatthebioactivitiesoftheendophyticfungifromA.curassavicaarediverse,whichlaysafoundationforexploringnewpotentialnaturalantitumor,antiinflammatory,hypoglycemicandantioxidantcompoundsfromtheendophyticfungiofA.curassavica.697B9528-575B-4F9E-B926-7C77DA6C1103
Keywords:Asclepiascurassavica,endophyticfungus,antitumor,antiinflammatory,αglucosidaseinhibitor,DPPHfreeradical,ITS
植物内生真菌是指在其生活史的一定阶段或全部阶段生活于健康植物的各种组织和器官内部,而不使宿主植物产生病变和排斥反应的真菌(Hardoimetal.,2015)。药用植物内生真菌在抗肿瘤、抗微生物、抗炎、抗氧化、降糖、杀虫等方面有较好的生物活性。Wei等(2020)从莞根中分离得到内生真菌pr10能显著抑制A549的生长;Ran等(2017)从喜树组織中分离获得能产抗肿瘤化合物喜树碱的内生真菌;Sailesh等(2020)从黄芩根中分离的内生真菌QF001,其代谢产物能够有效抑制LPS刺激Raw264.7中促炎细胞因子NO、TNFα和IL6的表达;Geethanjali等(2019)从长春花中分离的黑毛壳菌代谢物乙酸乙酯提取物具有较强的DPPH自由基清除活性;Afra等(2015)研究发现葫芦种子和苦杏内生真菌代谢物具有较强的抗氧化能力;郑喜等(2014;2015)从昆明山海棠中分离获得一株具有抑制α糖苷酶作用的链革孢属真菌ThF63和一株具有抗菌和杀虫活性的简青霉ThF11。因此,药用植物内生真菌被认为是活性天然产物的重要来源(Sanjanaetal.,2012)。近年来,从药用植物内生真菌中寻找新型天然活性化合物已成为新的研究热点,药用植物内生真菌代谢产物的多样性为寻找新颖天然活性化合物提供了有效途径。
马利筋(Asclepiascurassavica)是云南傣医常用药,性凉、味甘,具有调经活血、止痛退热、消炎散肿的功效(蒋振忠和冯德强,2006),被广泛用于强心、癌症、哮喘、发烧、炎症、腹泻、淋病、风湿、心血管等疾病的治疗(杨卫平等,2016;李冈荣,2017;蒋洪和宋纬文,2017)。目前,马利筋的研究主要集中在药效学方面,研究表明马利筋提取物具有抗菌、抗癌、心血管、镇痛、解热等多种药理活性(Raja&Ravindranadh,2014;Ali,2015);药效机制方面,Zheng等(2019)研究发现马利筋乙酸乙酯提取物能显著抑制A549、Hela、SKOV3、MGC803、NICH1975等多株肿瘤细胞的增殖,通过激活P38和JNKMAPK信号通路诱导NICH1975发生凋亡。然而,有关马利筋内生真菌及其生物活性的研究鲜有报道。
药用植物中蕴藏着丰富多样的内生真菌,与宿主植物长期进化使之能产生与宿主相同或相似的活性物质(王景仪等,2020)。Stierle等(1993)从红豆杉中分离获得产紫杉醇的内生真菌。因此,从药用植物内生真菌中寻找天然活性产物是一条有效的途径。基于此,我们提出了“马利筋内生真菌可能具有抗肿瘤、抗炎症和抗氧化等生物活性”的科学假说,并基于“药用植物-内生菌-生物活性”的研究思路,首次以马利筋内生真菌为研究对象,对168株西双版纳产马利筋内生真菌进行抗肿瘤、抗炎、α葡萄糖苷酶抑制及DPPH自由基清除等活性研究,以期为后续从中深入发掘潜在新型天然抗肿瘤、抗炎、降糖和抗氧化等活性化合物奠定良好基础,这对保护民族药马利筋野生资源具有重要意义。
1材料与方法
1.1内生真菌和供试细胞株
168株供试内生真菌是从产自云南西双版纳的新鲜马利筋的茎和叶中分离获得,其中茎中分离获得106株(MJF1~MJF106),叶中分离获得62株(MYF1~MYF62),菌株培养于PDA和PDB培养基中。供试细胞株为人肺腺癌细胞NICH1975、人乳腺癌细胞MCF7、人结肠癌细胞HCT116、人宫颈癌细胞Hela、人肝癌细胞株HepG2和小鼠单核巨噬细胞Raw264.7。其中,NICH1975和MCF7采用RPMI1640完全培养基培养,其他细胞株采用DMEM高糖完全培养基培养。以上细胞均购自中国科学院昆明动物研究所细胞库。
1.2培养基
马铃薯葡萄糖琼脂培养基(PDA):马铃薯200g,葡萄糖20g,琼脂15g,蒸馏水1000mL,pH自然。马铃薯葡萄糖液体培养基(PDB):马铃薯200g,葡萄糖20g,蒸馏水1000mL,pH自然。RPMI1640完全培养基:RPMI1640基础培养基900mL,胎牛血清100mL,双抗10mL,混合均匀。DMEM高糖完全培养基:DMEM高糖培养基900mL,胎牛血清100mL,双抗10mL,混合均匀,4℃冰箱保存、备用。
1.3主要仪器和设备
DHZ052D型恒温摇床(上海博彩生物科技有限公司)、DHP9052型恒温培养箱(上海一恒科技有限公司)、Heidolph型旋转蒸发仪(德祥科技有限公司)、SpectraMaxi3x型多功能酶标仪(美谷分子仪器(上海)有限公司)、二氧化碳培养箱(ThermofisherScientific)。
1.4内生真菌的培养及提取物的制备
挑取分离所得的马利筋内生真菌到新鲜PDA培养基上进行活化,活化后的内生真菌接种于PDB培养基中,28℃、150r·min1摇床培养8d,过滤菌丝,收集发酵液并用乙酸乙酯萃取3次,萃取物于旋转蒸发仪上浓缩得提取物浸膏,将提取物浸膏用DMSO溶解配成初始浓度200mg·mL1的母液,4℃冰箱保存、备用。
1.5肿瘤细胞毒活性测定
采用SRB法(Skehanetal.,1990)进行肿瘤细胞毒活性测定,取对数生长期的肿瘤细胞株NICH1975、MCF7、HCT116、Hela和HepG2按4×104个·mL1接种于96孔培养板中,每孔100μL,于37℃、5%CO2培养箱中培养24h,加入100μL不同浓度(40、20、10、5、2.5、1.25μg·mL1)提取物,每个浓度设3个复孔,同时设3个对照孔,置于CO2培养箱中继续培养48h,弃培养上清,每孔加入4℃预冷的10%的TCA100μL,4℃固定1h后用蒸馏水洗涤5次,空气中自然风干。每孔加入4mg·mL1的SRB溶液100μL,室温染色15min,弃上清液,用1%醋酸洗涤5次,空气干燥,每孔加入100μL的Tris(10mmol·L1)溶液,室温下放置5min,于560nm波长处测OD值。按以下公式计算各菌株提取物对肿瘤细胞的生长抑制率,半数抑制浓度IC50值采用Origin软件计算。697B9528-575B-4F9E-B926-7C77DA6C1103
I(%)=(Ay-Ac)/Ac×100。
式中:I代表抑制率;Ay代表给药组OD值;Ac代表对照组OD值。
1.6抗炎活性测定
1.6.1细胞活力测定采用SRB法(Skehanetal.,1990)检测各提取物对Raw264.7细胞活力的影响,取对数生长期细胞按每孔3×105个接种于96孔培养板中,每孔100μL,设置内生真菌提取物组和对照组,提取物组加入50μL不同浓度(10、5、2.5、1.25、0.625、0.3125、0.15625μg·mL1)提取物和50μLDMEM高糖完全培养基,對照组加入100μL培养基,每组设3个复孔,加药后,放于37℃、5%CO2培养箱中培养24h,SRB法检测Raw264.7细胞活力。
1.6.2LPS诱导的Raw264.7细胞中NO测定采用Griess法(Kimetal.,2020)进行NO检测,取对数生长期的Raw264.7细胞按每孔3×106个接种于96孔板中,每孔100μL。将细胞分为空白组(DMEM培养基)、模型组(1.5μg·mL1LPS+DMEM培养基)和内生真菌提取物组[1.5μg·mL1LPS+各浓度提取物(2.5、1.25、0.625、0.3125、0.15625μg·mL1)],每组设3个复孔。加药后,放于37℃、5%CO2培养箱中培养24h,收集培养上清,采用Griess法检测培养上清中NO水平。
1.6.3LPS诱导的Raw264.7细胞中IL6、IL1β和TNFα的测定按1.6.2的方法对Raw264.7细胞进行处理,按照酶联免疫吸附试剂盒说明书检测细胞培养上清中肿瘤坏死因子α(TNFα)、白细胞介素6(IL6)、白细胞介素1β(IL1β)水平,根据标准曲线,计算上清中各种炎症因子的含量。
1.7α葡萄糖苷酶抑制活性测定
参照郑喜等(2015)方法,将内生真菌提取物和阿卡波糖用pH6.8的磷酸盐缓冲液稀释至所需浓度,α葡萄糖苷酶冻干粉配成浓度为0.8U·mL1溶液,底物(PNPG)配成浓度2.5mmol·L1溶液。设置对照组(磷酸盐缓冲液+酶液+底物)、空白对照组(磷酸盐缓冲液)、样本测定组(磷酸盐缓冲液+提取物+酶液+底物)、样本对照组(磷酸盐缓冲液+提取物)和阳性对照组(磷酸盐缓冲液+阿卡波糖+酶液+底物),依次加入20μL提取物或阿卡波糖(5、2.5、1.25、0.625mg·mL1)、20μL磷酸钾缓冲液、20μLα葡萄糖苷酶,37℃恒温孵育15min后,加入20μL2.5mmol·L1的PNPG,37℃恒温反应15min,再加入80μL0.1mol·L1的NaCO3溶液终止反应,于405nm波长测吸光度值A。每个样本设3个复孔,实验重复3次。按以下公式计算抑制率,并用Origin软件计算IC50值。
I(%)=[1-(Ast-Asc)/(Ac-Ab)]×100。
式中:I代表抑制率;Ast代表样本测定组OD值;Asc代表样本对照组OD值;Ac代表对照组OD值;Ab代表空白对照组OD值。
1.8DPPH自由基清除活性测定
参照Guo等(2020)方法进行测定,将内生真菌提取物和维生素C用无水乙醇稀释至所需浓度,DPPH用无水乙醇配成0.2mmol·L1的溶液。分别将100μL各浓度测试提取物溶液(800、400、200、100、50μg·mL1)和100μLDPPH溶液加入到96孔板中,轻轻混匀,室温下避光静置反应30min后于517nm波长测定其吸光度As,同时测定100μLDPPH溶液与100μL无水乙醇混合后的吸光度Ab,以及200μL无水乙醇的吸光度值Aref。按以下公式计算提取物对DPPH自由基的清除率,并用Origin软件计算IC50值。
I(%)=[(As-Aref)-(Ab-Aref)]/(Ab-Aref)×100。
式中:I代表DPPH自由基清除率;As代表测试样本和DPPH混合溶液OD值;Ab代表DPPH和无水乙醇混合溶液OD值;Aref代表无水乙醇OD值。
1.9活性菌株的鉴定
参照谭小明等(2014)的方法进行活性菌株鉴定,将纯化好的活性菌株菌丝(0.5~1g)在液氮中迅速研磨成粉,参照天根真菌DNA提取试剂盒的操作说明提取真菌DNA。同时,采用通用引物ITS4(TCCTCCGCTTATTGATATGC)和ITS5(GGAAGTAAAAGTCGTAACAAGG)按以下反应条件进行PCR扩增:95℃,4min;95℃,30s,56℃,30s,72℃,1min,30个循环;72℃,10min。PCR扩增产物取5μL进行琼脂糖凝胶电泳检测,并委托擎科生物技术有限公司测序,反馈序列通过NCBI(http://blast.ncbi.nlm.nih.gov/)进行比对,确定活性菌株种属。
2结果与分析
2.1马利筋内生真菌代谢产物对肿瘤细胞生存率的影响
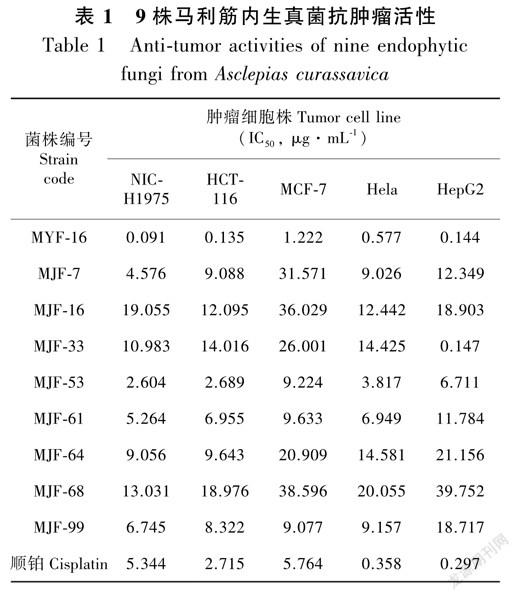
采用SRB法测定168株马利筋内生真菌抗肿瘤活性,结果见表1。从表1可以看出,9株内生真菌提取物表现出广谱而显著细胞毒作用,其中以MYF16活性最强,活性强于顺铂。大部分活性菌株对NICH1975、HCT116和Hela较MCF7和HepG2敏感,具有更好的抑制作用;菌株MJF33对HepG2肿瘤细胞较为敏感,其IC50为0.147μg·mL1,而对其他4株肿瘤细胞的IC50>10μg·mL1;从菌株分布来看,活性菌株主要集中于马利筋的茎,有8株,而叶中仅获得1株活性菌株MYF16;来源于茎中的内生真菌活性弱于叶中内生真菌,可能跟宿主马利筋抗肿瘤活性成分主要集中于叶有关。
2.2MJF53对LPS诱导的Raw264.7细胞中IL6、IL1β和TNFα的影响697B9528-575B-4F9E-B926-7C77DA6C1103
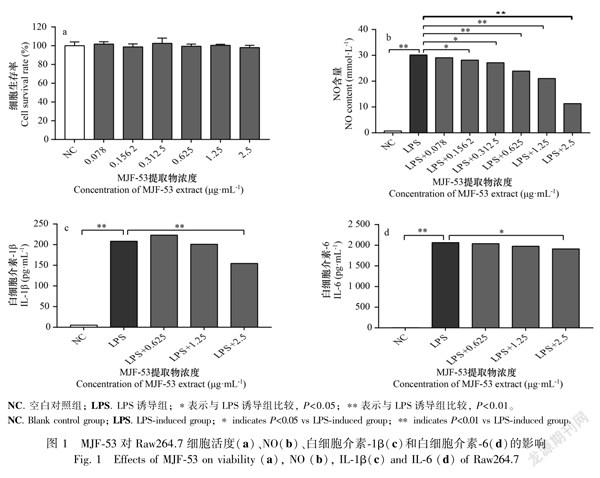
通过建立炎症细胞模型,测定各内生真菌代谢物对Raw264.7细胞中NO的影响,发现菌株
MJF53在浓度小于2.5μg·mL1时对细胞无毒性,且能浓度依赖性抑制NO的分泌(图1:a,b)。进一步测定MJF53对LPS诱导的Raw264.7细胞中IL6、IL1β和TNFα的影响,发现该菌株提取物在浓度2.5μg·mL1时能选择性抑制IL1β的产生,而对TNFα和IL6的分泌无影响(图1:c,d),推测MJF53可能通过选择性抑制促炎因子IL1β分泌上游相关信号通路从而抑制炎症发生。
2.3马利筋内生真菌代谢产物对α葡萄糖苷酶活性的影响
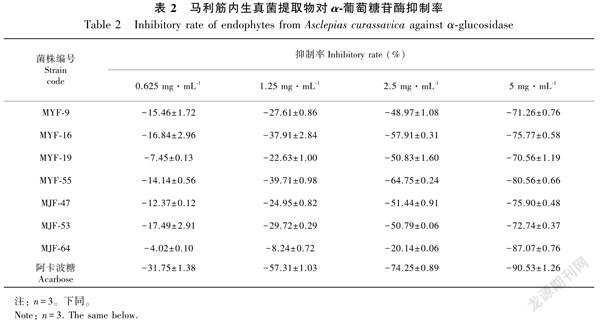
通过α葡萄糖苷酶抑制活性筛选获得7株对α葡萄糖苷酶具有较好抑制活性的内生真菌,抑制作用呈浓度依赖性,在浓度5mg·mL1时对α葡萄糖苷酶表现出显著抑制作用,抑制率>70%,各活性菌株IC50值均小于4mg·mL1。其中,MYF16和MYF55对α葡萄糖苷酶的抑制活性最强,其IC50值分别为1.996和1.823mg·mL1,抑制活性接近阿卡波糖。结果见表2和表3。
2.4马利筋内生真菌代谢产物对DPPH自由基清除活性的影响
采用DPPH法对168株内生真菌提取物进行抗氧化活性测定,发现在浓度800μg·mL1时,有19株内生真菌提取物对DPPH自由基的清除率均在50%以上,其中11株清除率在80%以上,菌株MYF9、MYF19和MJF84表现出较强的抗氧化活性,IC50分别为13.562、17.776和12.395μg·mL1。从菌株分布来看,DPPH自由基清除活性菌株有13株分布于马利筋的茎中,6株分布于叶中。结果见表4和表5。
2.5活性菌株ITS鉴定结果
NCBI比对发现活性菌株序列相似度均接近100%,主要分布于链格孢属(Alternariasp.)、刺盘孢属(Colletotrichumsp.)、镰刀菌属(Fusariumsp.)、间座壳属(Diaporthesp.)、踝节菌属(Talaromycessp.)和新壳梭孢属(Neofusicoccumsp.)6个属,结果见表6。从表6可以看出,活性菌株主要集中分布于链格孢属和间座壳属2个属,其中9株属于链格孢属,5株属于间座壳属,其他4个属仅有8株,链格孢属和间座壳属可能是马利筋优势活性菌株种属。
3讨论与结论
药用植物内生真菌能产生结构新颖、种类多样和生物活性广泛的次生代谢产物,是活性天然产物的重要来源(Geethanjalietal.,2019)。在与宿主长期共寄生过程中宿主可能将其遗传物质或信息传递给其内生真菌,使之具有和宿主相同或类似的代谢途径,导致内生真菌能够产生与宿主相同或相似生物活性的物质。马利筋作为傣药被广泛用于癌症、哮喘、强心、炎癥、风湿、发烧、腹泻、淋病和心血管等疾病的治疗(蒋洪和宋纬文,2017;李冈荣,2017),提示其具有多种生物活性,以抗肿瘤和抗炎活性引起广泛关注。前期研究我们发现马利筋具有显著而广谱的抗肿瘤活性,通过激活p38和JNKMAPK信号通路诱导NICH1975细胞凋亡介导抗肿瘤(Zhengetal.,2019)。本研究发现MYF16具有显著而广谱的生物活性,其抗肿瘤活性尤为显著,对NICH1975最强,推测MYF16可能产生宿主马利筋相同或相似生物活性的物质,研究结果与前期报道的红豆杉内生真菌能产紫杉醇(Stierleetal.,1993;Somjaipengetal.,2015)以及喜树内生真菌产喜树碱(Ranetal.,2017)相似。因此,活性菌株MYF16可作为目标菌株进一步深入探讨其活性代谢产物及抗肿瘤作用机制。
NLRP3炎症小体的激活在调节炎症反应中具有重要作用(Maoetal.,2017)。ATP等信号分子
促进胞内钾离子外流介导NLRP3、ASC和caspase1组装成蛋白嵌合体,进而激活caspase1自身剪切产生p20和p10两个亚基,介导促炎因子IL1β和IL18剪切成熟释放,导致炎症反应的发生(丁杨和胡容,2018)。本研究发现,菌株MJF53在2.5μg·mL1时无明显毒性且能有效抑制LPS诱导的Raw264.7中促炎因子NO和IL1β的分泌,推测该菌株可能产生抑制IL1β分泌的抗炎活性成分,通过抑制NLRP3炎症小体激活抑制IL1β剪切成熟释放介导抗炎作用,具体的抗炎机制及体内抗炎作用需要进一步深入确证。
药用植物中蕴藏着丰富多样的内生真菌,内生真菌是天然活性化合物的重要来源。ITS鉴定发现,22株活性菌株分属于链格孢属、刺盘孢属、镰刀菌属、间座壳属、踝节菌属和新壳梭孢属6个属,其中9株属于链格孢属,5株属于间座壳属,广谱活性菌株MYF16、MJF53和MJF64也分属于这2个属。由此推测,链格孢属和间座壳属可能是马利筋优势内生真菌,结果与谭小明等(2015)报道的链格孢属、镰刀菌属、刺盘孢属等真菌是药用植物的优势菌群相符。此外,内生真菌资源多样性与宿主植物所处的环境密切有关,刘芸等(2010)研究表明虎杖组织中内生真菌的种类和数量与季节密切相关;贾敏等(2014)研究发现不同
地域银杏内生真菌的种类差别很大。因此,为了获得更加丰富的马利筋活性内生真菌资源,可以选择不同季节、多个采样点进行采样后对不同部位进行分离、鉴定。
综上所述,本研究筛选获得多株具有抗肿瘤、抗炎、抑制α葡萄糖苷酶和清除DPPH自由基等活性的菌株,为从马利筋内生真菌中深入发掘抗肿瘤、抗炎、降糖和抗氧化活性物质奠定基础,对于开发傣药马利筋植物资源和拓展傣药马利筋应用具有一定的指导意义。
参考文献:
AFRAK,IETIDALM,JUSTINNET,etal.,2015.Apilotstudyofantioxidantpotentialofendophyticfungifromsomesudanesemedicinalplants[J].AsianPacJTropMed,8(9):701-704.697B9528-575B-4F9E-B926-7C77DA6C1103
AISNAFIAE,2015.ChemicalconstituentsandpharmacologicaleffectsofAsclepiascurassavica—areview[J].AsianJPharmClinRes,5(2):83-87.
DINGY,HUR,2018.ResearchprogressinmechanismsofNLRP3inflammasomeactivationandregulation[J].ProgPharmSci,42(4):294-302.[丁杨,胡容,2018.NLRP3炎症小体激活及调节机制的研究进展[J].药学进展,42(4):294-302.]
GEETHANJALID,KAMALRAJS,JAYABASKARANC,2019.DiversityandbiologicalactivitiesofendophyticfungiassociatedwithCatharanthusroseus[J].BMCMicrobiol,19(1):22.
GUOL,MAJY,MAYZ,etal.,2020.Orthogonaltestdesignforoptimizationoftheextractionofpolysaccharidesfrominonotuscuticularisandtheirantioxidantactivities[J].ChemBiodivers,17:e2000326.
HARDOIMPR,OVERBEEKLS,BERGG,etal.,2015.Thehiddenworldwithinplants:ecologicalandevolutionaryconsiderationsfordefiningfunctioningofmicrobialendophytes[J].MicrobiolMolBiolRev,79(3):293-320.
JIAM,JIANGYP,ZHANGW,etal.,2014.ComparisonondiversityofendophyticfungifromGinkgobilobainTianmuMountainandJiandearea[J].DrugsClin,29(3):262-268.[贾敏,蒋益萍,张伟,等,2014.浙江天目山和建德地区产银杏中内生真菌多样性的比较研究[J].现代药物与临床,29(3):262-268.]
JIANGH,SONGWW,2017.PracticalpictureofChineseherbalmedicine[M].Fuzhou:FujianScienceandTechnologyPress:393.[蔣洪,宋纬文,2017.中草药实用图典[M].福州:福建科学技术出版社:393.]
JIANGZZ,FENGDQ,2006.ResearchontraditionalmedicineofDaiNationalityinSimao[M].Chengdu:SichuanScienceandTechnologyPress:155-199.[蒋振忠,冯德强,2006.思茅傣族传统医药研究[M].成都:四川科学技术出版社:155-199.]
KIMNH,KIMHK,LEEJH,etal.,2020.JuglonesuppressesLPSinducedinflammatoryresponsesandNLRP3activationinmacrophages[J].Molecules,25(13):3104.
LIGR,2017.Coloratlasof800kindsofchineseherbalmedicine[M].Fuzhou:FujianScienceandTechnologyPress:502.[李冈荣,2017.800种中草药彩色图鉴[M].福州:福建科学技术出版社:502.]
LIUY,YINH,QIUNX,etal.,2010.IsolationandidentificationofanendophyticfungusproducingresveratrolinPalygonumcuspidatum[J].Mycosystema,29(4):502-507.[刘芸,殷红,仇农学,2010.一株产白藜芦醇虎杖内生真菌的分离和鉴定[J].菌物学报,29(4):502-507.]
MAOZJ,LIUCC,JISQ,etal.,2017.TheNLRP3inflammasomeisinvolvedinthepathogenesisofparkinsonsdiseaseinrats[J].NeurochemRes,42:1104-1115.
PATELMN,CARROLLRG,GALVANPS,etal.,2017.Inflammasomepriminginsterileinflammatorydisease[J].TrendsMolMed,23(2):165-180.
RAJAS,RAVINDRANADHK,2014.Asclepiascurassavica:areviewofethnomedical,phytochemicalandpharmacologicalinformation[J].IndoAmJPharmRes,4(4):2151-2169.
RANXQ,ZHANGG,LIS,etal.,2017.CharacterizationandantitumoractivityofcamptothecinfromendophyticfungusFusariumsolaniisolatedfromCamptothecaacuminate[J].AfrHealthSci,17(2):566-574.697B9528-575B-4F9E-B926-7C77DA6C1103
SAILESHM,SANGBL,GEUMJK,etal.,2020.IsolationofunstableisomersoflucilactaeneandevaluationofantiinflammatoryactivityofsecondarymetabolitesproducedbytheendophyticfungusFusariumsp.QF001fromtherootsofScutellariabaicalensis[J].Molecules,25(4):923.
SANJANAK,SURUCHIG,MAROOFA,etal.,2012.Endophyticfungifrommedicinalplants:atreasurehuntforbioactivemetabolites[J].PhytochemRev,11:487-505.
SKEHANP,STORENGR,SCUDIEROD,etal.,1990.Newcolorimetriccytotoxicityassayforanticancerdrugscreening[J].JNatlCancerInst,82(13):1107-1112.
SOMJAIPENGS,MEDINAA,KWASNAH,etal.,2015.Isolation,identification,andecologyofgrowthandtaxolproductionbyanendophyticstrainofparaconiothyriumvariabilefromenglishyewtrees(Taxxsbaccata)[J].FungalBiol,119(11):1022-1031.
STIERLEA,STROBELG,STIERLED,1993.Taxolandtaxaneproductionbytaxomycesandreanae,anendophyticfungusofpacificyew[J].Science,260(5105):214-216.
TANXM,YULY,ZHOUYQ,2014.Isolation,identificationandantimicrobialactivitiesofendophyticfungiofDysosmaversipellis(Hance)M.Cheng[J].ChinPharmJ,49(5):363-366.[谭小明,余丽莹,周雅琴,2014.濒危药用植物八角莲内生真菌分离鉴定及抗菌活性研究[J].中国药学杂志,49(5):363-366.]
TANXM,ZHOUYQ,CHENJ,etal.,2015.Advancesinresearchondiversityofendophyticfungifrommedicinalplants[J].ChinPharmJ,50(18):1563-1580.[谭小明,周雅琴,陈娟,等,2015.药用植物内生真菌多样性研究进展[J].中国药学杂志,50(18):1563-1580.]
WANGJY,LIMQ,LIYR,etal.,2020.Researchprogressondiversityandbiologicalfunctionofendophyticfungiinmedicinalplants[J].BioticResour,42(2):164-172.[王景仪,李梦秋,李艳茹,等,2020.药用植物内生真菌的多样性及生物功能研究进展[J].生物资源,42(2):164-172.]
WEIJ,CHENF,LIUYM,etal.,2020.ComparativemetabolomicsrevealedthepotentialantitumorcharacteristicsoffourendophyticfungiofBrassicarapaL.[J].ACSOmega,5(11):5939-5950.
ZHENGX,LIGH,WANGX,etal.,2014.AntibacterialandnematicidalactivityofendophyteThF11Tripterygiumhypoglaucum(Levl.)Hutch[J].ChinPharmacolBull,30(12):1709-1713.[郑喜,李国红,王芯,等,2014.昆明山海棠内生真菌ThF11化学成分抗菌杀线虫作用的研究[J].中国药理学通报,30(12):1709-1713.]
ZHENGX,LIGH,WANGX,etal.,2015.ScreeningandstrainsidentificationofαglucosidaseinhibitoryactivityfromendophytesofTripterygiumhypoglaucum[J].ChinJExpTraditMedForm,21(23):149-153.[郑喜,李国红,王芯,等,2015.昆明山海棠内生真菌α糖苷酶抑制活性的筛选及菌株鉴定[J].中国实验方剂学杂志,21(23):149-153.]
ZHENGX,XUY,LIUB,etal.,2019.EthylacetateextractofAsclepiascurassavicainducedapoptosisinhumancancercellsviaactivatingp38andJNKMAPKsignalingpathways[J].EvidBasedComplAlternMed,2019:9076269.
(責任编辑蒋巧媛)
收稿日期:2021-03-20
基金项目:国家自然科学基金(81960745);云南省基础研究计划面上项目(2019FB123);云南省科技厅-云南中医药大学中医联合专项(2018FF001[077]),2018FF001[009])
第一作者:殷娜(1994-),硕士研究生,研究方向为天然药物作用及机制,(Email)2711732008@qq.com。
通信作者:郑喜,硕士,助理研究员,研究方向为中药和微生物天然产物药理,(Email)Zhengxi138@163.com。697B9528-575B-4F9E-B926-7C77DA6C1103
猜你喜欢 内生真菌抗肿瘤抗炎 美洲大蠊提取物CⅡ—3对家兔血常规及抗氧化活性的影响中国民族民间医药·上半月(2016年12期)2017-01-11黄草乌根部内生真菌的分离与鉴定中国医药导报(2016年30期)2016-12-28白藜芦醇的抗炎、抗氧化作用与帕金森病治疗的探讨考试周刊(2016年90期)2016-12-01菜豆植物凝集素对肿瘤细胞增殖的抑制作用科教导刊(2016年26期)2016-11-15鸦胆子油剂型研究进展科技视界(2016年23期)2016-11-04“抗炎”是防治重大疾病的关键家庭科学·新健康(2016年8期)2016-09-30大蒜素临床药理作用的研究进展科教导刊·电子版(2016年14期)2016-06-25保肺定喘汤镇咳、祛痰、抗炎作用的实验研究浙江中医杂志(2004年5期)2004-03-09




