刁卓 钱扬义 王立新 唐文秀







摘要:
借助手持技术数字化实验手段,分别设计CO2、 SO2与H2O反应相关的四个实验。利用四重表征分析比较CO2、 SO2与H2O反应的实验过程,从宏微结合的视角发展学生“宏观辨识与微观探析”化学学科核心素养,丰富了手持技术数字化实验案例,为教师进行教学提供参考。
关键词:
手持技术; 宏观辨识与微观探析; pH传感器; 四重表征
文章编号:
1005-6629(2022)05-0062-06
中图分类号:
G633.8
文献标识码:
B
1 问题的提出
“宏观辨识与微观探析”是五大化学学科核心素养之一,要求学生能够通过观察宏观现象,结合微观视角对已有知识进行辨识、探析,运用符号表征物质及其变化等。美国颁布的《新一代科学教育标准》中亦要求学生能够从分子和亚原子水平对宏观的化学物质和过程做出解释和预测[1]。
元素化合物知识的学习是培养学生该素养的重要载体。CO2、 SO2是两种重要的酸性氧化物,与H2O反应是两种物质的重要性质之一,教材中也编排了相应的实验。如人教版初中化学教材利用四朵染有紫色石蕊试液的干燥纸花探究CO2与H2O反应[2];人教版高中化学必修第二册则是利用实验探究SO2与水反应[3]。初中教材中实验准备工作繁冗,操作步骤复杂,易让学生混淆;高中教材的实验则存在SO2气体泄漏的问题。
上述两个实验,学生仅能从宏观层面了解CO2、 SO2与H2O发生反应,但不能从微观层面理解发生反应的本质。而且,学生仅仅知道CO2、 SO2与H2O反应均生成了酸这一共性,但不清楚二者与H2O反应的差异性究竟体现于何处,如二者在水中溶解度的不同、与水反应生成酸的酸性不同、化合价均呈现正四价的S元素和C元素还原性不同等等。
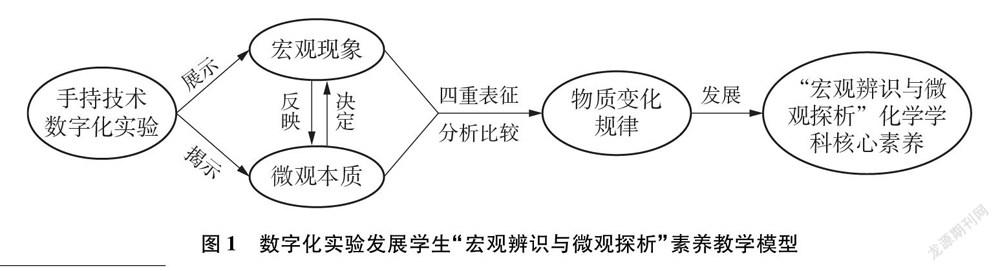
为此,我们借助手持技术数字化实验和图1所示的教学模型,分别设计CO2、 SO2与H2O反应相关的四组实验,旨在达到如下目的:
(1)借助手持技术展示CO2、 SO2与H2O反应过程的微观本质;(2)借助手持技术帮助学生理解CO2、 SO2与H2O反应的异同点;(3)借助手持技术帮助学生认识化合价均呈现正四价的S元素和C元素还原性的差异。
2 促进问题解决的手持技术数字化实验设计
2.1 实验方案
方案设计如表1所示。
2.2 实验用品
实验仪器:
平板电脑(安装Multilab软件)、数据采集器、pH传感器、温度传感器、分液漏斗、圆底烧瓶、乳胶管、胶塞、磁力搅拌器、磁子、锥形瓶(100mL)、烧杯(250mL)、容量瓶(500mL)、胶头滴管、铁架台、不同规格弯管若干、酒精灯、三脚架、石棉网、普通漏斗、量筒等
实验试剂:
Na2CO3(AR)、浓H2SO4(AR)、 Na2SO3(AR)、 NaOH(AR)、紫色石蕊指示剂(AR)
2.3 实验装置
除了手持技术相关配套仪器外,实验装置的设计考虑以下几个方面:
(1)实验中SO2为有毒气体,故在实验2、实验3实验装置中,特设计尾气吸收装置以保证实验的绿色化;(2)实验中空气中的氧气为干扰变量,故实验1、实验3实验装置采用了密闭装置,又因为随着参与反应的气体不断通入,排出装置中原本的空气,所以在一定程度上排除了空气中氧气的干扰;(3)实验目的之一是对比探究CO2和SO2与水的反应,故CO2系列实验和SO2系列实验采用相似的实验装置。基本装置如图2、图3所示。
2.4 实验步骤
2.4.1 实验1操作步骤
(1) 校正pH传感器;
(2) 按照图2组装仪器,并检查装置气密性;
(3) 将适量Na2CO3固体加入圆底烧瓶中,使其均匀铺满锥形瓶底部,并用量筒量取40mL H2SO4(1mol/L)溶液于分液漏斗中,作为气体发生装置;
(4) 取NaOH(10%)溶液150mL于大烧杯(250mL)中,作为尾气吸收装置;
(5) 取80mL的去离子水于锥形瓶(100mL)中,并滴入紫色石蕊指示剂。安装好pH传感器,加入磁子并开启磁力搅拌器;
(6) 开启数据采集器,设置采集器采样频率为1次/s,时间为“连续”,运行软件。待读数稳定后,转动分液漏斗活塞,控制H2SO4(1mol/L)溶液的流速,使气体均匀地通入集气瓶中;
(7) 观察现象并及时记录反应过程中pH变化。当体系pH稳定后,结束实验并保存相关图形与数据;
(8) 保留锥形瓶中溶液,记录为溶液1。
2.4.2 实验2操作步骤
(1) 按照圖3组装仪器,固定好温度传感器和pH传感器并将其插入溶液1中;
(2) 开启数据采集器,设置采集器采样频率为1次/s,时间为“连续”,运行软件。待读数稳定后,点燃酒精灯,对溶液1进行加热;
(3) 观察现象并及时记录反应过程中pH和温度的变化。当该体系pH和温度稳定之后,结束实验并保存相关图形与数据。
2.4.3 实验3操作步骤
按照实验1操作步骤进行实验。对实验药品进行更换,将分液漏斗中液体换成浓硫酸,将圆底烧瓶内固体换成Na2SO3,其他操作步骤不变。最后得到溶液记录为溶液2。
2.4.4 实验4的操作步骤
按照实验2操作步骤进行实验。对实验3所得溶液2进行加热,其他操作步骤不变。
3 实验数据分析
为保证实验的重现性和准确性,本文实验均进行了三次以上的重复性实验。每个实验中选择其中一条曲线对应的数据进行处理。笔者将曲线数据导入Origin8.0软件作图,整合为较直观的曲线表征,并结合宏观现象(宏观表征)、主要方程式(符号表征)、溶液中主要微观粒子(微观表征)三个方面,利用四重表征理论[4~8]进行分析(该实验中,石蕊作为指示剂参与反应,目的在于表征宏观现象,故不对其涉及的化学反应进行微观和符号表征)。
3.1 CO2与H2O反应实验分析
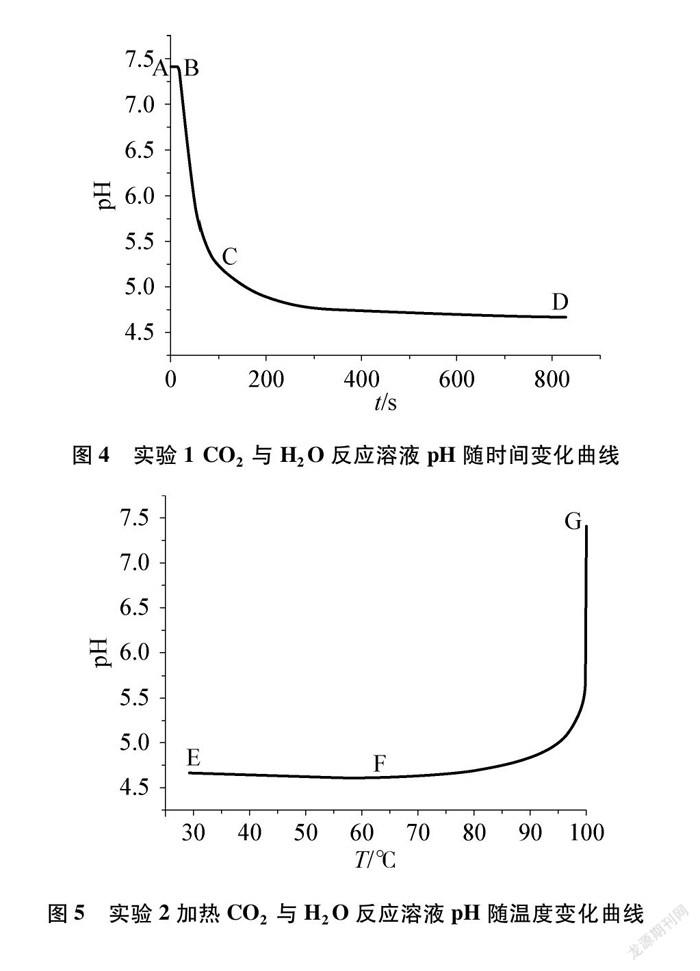
图4、图5分别为实验1 CO2与H2O反应和实验2加热CO2与H2O反应后溶液的pH随时间变化曲线,利用四重表征理论对实验结果进行分析,详见表2、表3。
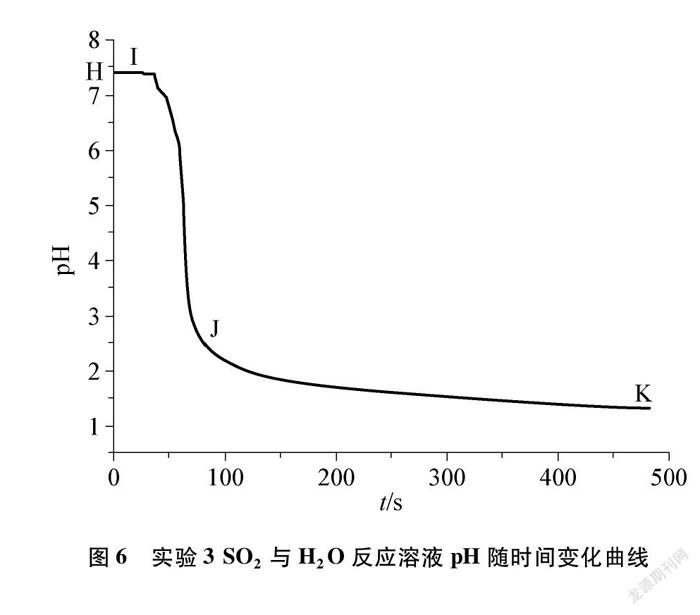
3.2 SO2与H2O反应实验分析
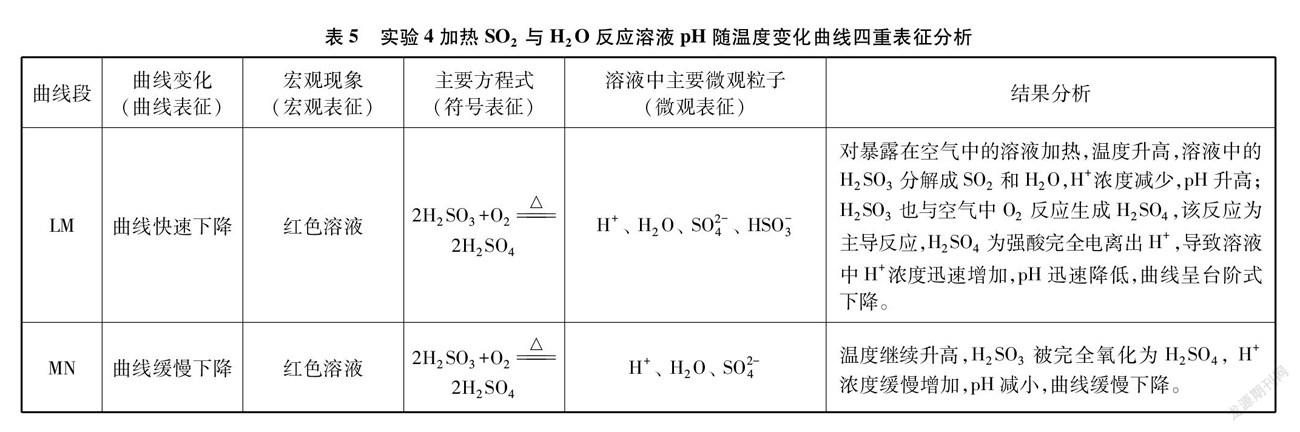
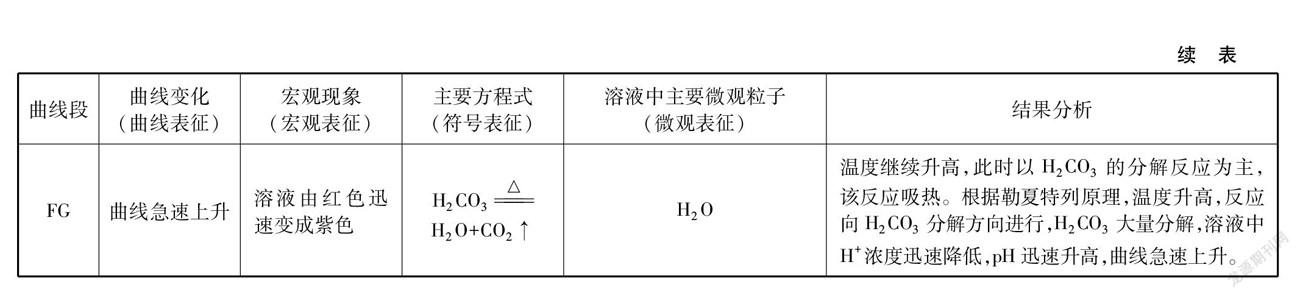
4加热SO2与H2O反应后溶液的pH随时间变化曲线,利用四重表征理论对实验结果进行分析,详见表4、表5。
3.3 CO2、 SO2与H2O反应对比分析
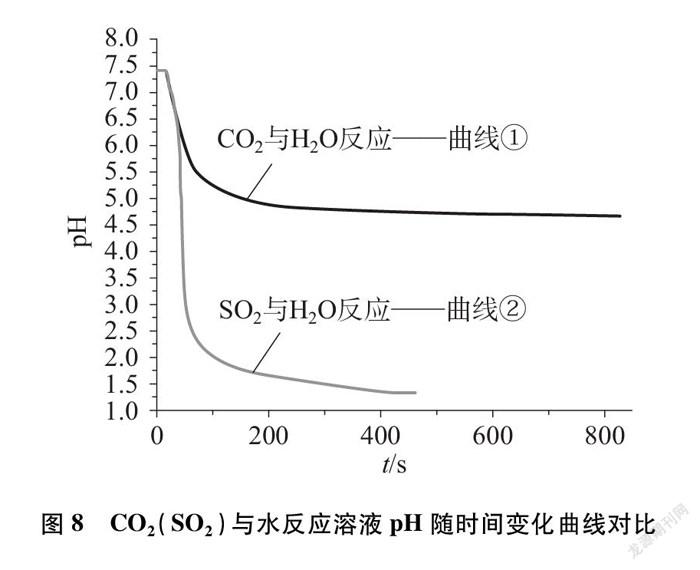
3.3.1 实验1与实验3曲线对比分析
如图8所示,分析数据有以下异同点:
(1)曲线均呈下降趋势:
CO2和H2O反应生成H2CO3,SO2与H2O反应生成H2SO3,溶液中H+浓度均增加,pH下降,曲线均下降;(2)曲线①在曲线②上方:
CO2和H2O反应生成的H2CO3为弱酸,SO2与H2O反应生成的H2SO3为中强酸,H2SO3的电离常数(25℃, K1=1.3×10-2)远大于H2CO3的电离常数(25℃, K1=4.30×10-7),所以H2SO3的酸性相对H2CO3较强,CO2溶解度[1.26g/L(水,30℃, 101kPa)]小于SO2溶解度[78g/L(水,30℃, 101kPa)],相同体积的水中,溶解于水中SO2比CO2多,SO2与H2O反应生成的H2SO3较多,CO2与H2O反应生成的H2CO3相对较少[9,10],故曲线①在曲线②上方;(3)曲线①下降相对较慢,曲线②急速下降:
H2SO3的电离常数大于H2CO3的电离常数,在相同时间内,H2SO3电离出的H+浓度大于H2CO3电离出的H+浓度,所以曲线②下降速度较快。
3.3.2 实验2与实验4曲线对比分析
如图9所示,CO2与H2O反应溶液中H2CO3随着温度升高,受热分解成CO2和H2O,导致溶液H+浓度降低,pH升高,曲线③上升;SO2与H2O反应生成的H2SO3暴露在空气中,被氧化成H2SO4,溶液中H+浓度升高,pH降低,曲线④下降。
4 实验结果讨论
(1) 本文借助手持技术设计实验1、实验3,通过实验的宏观现象,测量溶液中微观粒子H+浓度的变化,利用pH曲线的变化直观呈现CO2、 SO2与H2O反应的微观过程。教师应用四重表征理论引导学生探究CO2、 SO2与H2O反应的微观本质,从宏微结合的视角构建学生“宏观辨识与微观探析”的学科核心素养。
(2) 通过对实验1、实验3中的曲线变化对比分析CO2、 SO2与H2O反应的异同点。CO2与H2O反应和SO2与H2O反应均使溶液的pH降低。pH曲线下降,说明两者反应均生成了酸。但二者反应pH曲线变化趋势上存在差异,由于CO2、 SO2的溶解度不同、与水反应生成H2CO3、 H2SO3的电离常数不同而导致酸性不同。
(3) 通过实验2、实验4的结果,分析温度对CO2、 SO2与H2O反应溶液成分的影响及反应原理。加热CO2与H2O反应时溶液pH升高,而加热SO2与H2O反应时溶液pH降低,分析可知二者溶液均暴露在空气中加热,CO2與H2O反应生成的H2CO3难以被氧化,但不稳定性受热易分解;而SO2与H2O反应生成的H2SO3中S元素具有还原性,亚硫酸被O2氧化生成H2SO4, H2SO4较稳定,受热不易分解。说明H2SO3中S元素的还原性大于H2CO3中C元素的还原性。
5 教学建议
5.1 实验关键点
(1) 在进行CO2、 SO2与H2O反应的实验时,要保证装置的气密性,并且要在通风条件下进行。
(2) 为得到较为纯净的CO2和SO2气体,又要考虑实验装置的简易性,本实验根据相关文献,特选择了Na2SO3和浓H2SO4反应制备SO2、 Na2CO3和稀H2SO4反应制备CO2。
(3) 为保证实验所得数据的可靠性,通入CO2和SO2气体的气流要平缓、连续且速度一致,导管应尽可能插入水溶液底部,同时装置要置于磁力搅拌器上进行搅拌,以增大CO2、 SO2与H2O的接触面积。
5.2 实验教学建议
本研究中的实验可用于不同学段的教学。例如,CO2与H2O反应及加热其溶液的实验可用于初三阶段的二氧化碳性质的教学,教师在教学时需要补充与pH相关的知识,仅从溶液的pH改变这点切入教学,不对曲线变化趋势原因进行深入分析;SO2与H2O反应及加热其溶液的实验则用于高一阶段二氧化硫性质的教学,教师根据学生的认知程度,选择合适的实验分析角度进行课堂教学。本研究的四个实验更适用于已学习化学选修4相关知识的学生进行研究性学习和科学探究活动,学生在进行实验的过程中,可以收集手持技术产生的曲线证据,并利用已学的知识对曲线得到的证据进行分析推理,避免对知识的死记硬背,培养学生科学探究与证据推理的能力。与此同时,学生通过观察反应的宏观现象,分析曲线变化,探析反应的微观本质,发展学生“宏观辨识与微观探析”化学学科核心素养。
5.3 改进方向
在实验设计方面,可在进行SO2与H2O反应实验时通入惰性气体,以排除氧气的干扰;在研究对象方面,可利用手持技术对比探究SO2、 CO2的其他性质,深化二者的学习。
利用手持技术数字化实验手段进行四重表征分析的问题解决模式为学生深入学习元素化合物的相关知识以及发展“宏观辨识与微观探析”化学学科核心素养提供了方向。
参考文献:
[1]Talanquer V., Sevian H.. Chemistry in Past and New Science Frameworks and Standards:
Gains, Losses, and Missed Opportunities [J]. Journal of chemical education, 2014, 91(1):
24~29.
[2]王晶, 郑长龙. 义务教育教科书·化学九年级上册[M]. 北京:
人民教育出版社, 2012:
118.
[3]王晶, 毕华林. 普通高中教科书·化学必修第二册[M]. 北京:
人民教育出版社, 2019:
3.
[4]王立新, 钱扬义, 李言萍, 陈博殷, 梁宏宇. 手持技术支持下概念学习的“多重转化、比较建构”认知模型——以“温室效应”概念学习为例[J]. 电化教育研究, 2017, 38(10):
100.
[5]钱扬义, 叶静怡, 邓峰, 等. 手持技术在化学学习中的应用与建模研究[M]. 北京:
科学出版社, 2009.
[6]钱扬义, 杜永锋, 李佳, 等. 掌上实验室(Labin Hand)的特点及其功能[J]. 电化教育研究, 2003, (10):
59~62.
[7]钱扬义, 陈建斌. 在“数字化掌上实验室”中做科学[J]. 中国电化教育, 2004, (5):
45~48.
[8]林建芬, 盛晓婧, 钱扬义. 化学“四重表征”教学模式的理论建构与实践研究——从15年手持技术数字化实验研究的回顾谈起[J]. 化学教育, 2015, 36(7):
1~6.
[9]王玉芝. 实用大学化学手册[M]. 长沙:
湖南科学技术出版社, 2015:
610.
[10]实用化学手册编写组. 实用化学手册[M]. 北京:
科学出版社, 2001:
415.