阮鹏 曾毅 胡颖嵩






[摘要]目的探討骨髓间充质干细胞(BMMSCs)浓度对调节性T细胞(Treg)/辅助性T细胞17(Th17)表达的影响。方法贴壁法提取大鼠BMMSCs并传代培养至P4代,油红O染色法及钙盐染色法测定P3代成脂及成骨诱导能力。倒置显微镜下标记CD29、CD90、CD45荧光抗体。磁珠法分选大鼠CD4+T细胞,流式细胞仪测定细胞纯度。将CD4+T细胞与浓度不同的BMMSCs(0.5倍、1倍、2倍、4倍浓度组)共培养3 d,流式细胞仪测定Treg、Th17增值比例,流式微球分析法检测转化生长因子-β(TGF-β)及白介素(IL-6、IL-10、IL-17)水平。结果本研究P4代BMMSCs形态均匀,且呈梭形紧密排列,成脂诱导后镜下呈现橘红色脂肪小滴,成骨诱导后镜下呈现黑钙盐结节。CD90、CD29于BMMSCs表面阳性表达,CD45弱表达。磁珠法分选出CD4+T细胞约(5.75±0.36)×10个/ml,细胞纯度>95%。共培养后,在Treg增殖比例上,2倍>1倍>0.5倍>4倍浓度组,2倍浓度组与其他各组比较,差异有统计学意义(P<0.05)。在Th17增殖比例上,1倍>2倍>0.5倍>4倍浓度组,0.5倍浓度组与各组组间比较,4倍浓度组与1倍、2倍浓度组比较,差异有统计学意义(P<0.05)。在TGF-β水平上,1倍>2倍>4倍>0.5倍浓度组,1倍浓度组与0.5倍、4倍浓度组组间比较,差异有统计学意义(P<0.05)。在IL-10水平上,2倍>1倍〉4倍〉0.5倍浓度组,0.5倍浓度组与其他各组比较,差异有统计学意义(P<0.05)。在IL-6、IL-17水平上,各组组间比较,差异无统计学意义(P>0.05)。结论BMMSCs具多向分化潜能,CD4+T细胞分化成Treg、Th17的增殖比例受到BMMSCs浓度的影响,较高浓度时增殖效应最强,高浓度时抑制增殖,两者增殖比例变化与相关因子表达水平并不同步。
[关键词]骨髓间充质干细胞;调节性T细胞;辅助性T细胞17;浓度调节
[中图分类号]R329.2 [文献标识码]A [文章编号]2095-0616(2022)05-0031-05
Study on the regulation of Treg/Th17 expression by the concentration of bone marrow mesenchymal stem cells
RUAN Peng1 ZENG Yi1 HU Yingsong2
1. Inspection Department,Wuhan Zhongtong Lanbo Medical Laboratory Co.,Ltd,Hubei,Wuhan 430000,China;
2. Department of Laboratory Medicine,Hubei Provincial Hospital of Integrated Traditional Chinese and Western Medicine,Hubei,Wuhan 430000,China
[Abstract]Objective To investigate the effect of the concentration of bone marrow mesenchymal stem cells (BMMSCs)on the expression of regulatory T cells (Treg)/ T helper 17 cells (Th17). Methods Rat BMMSCs were extracted by adherence culture method and subcultured to P4 generation,and the lipogenic and osteogenic induction potential of P3 generation was determined by oil red O staining and calcium salt staining. CD29,CD90 and CD45 fluorescent antibodies were labeled under inverted microscope. Rat CD4+ T cells were sorted by magnetic bead method,and cell purity was determined by flow cytometry. CD4+ T cells were co-cultured with BMMSCs of different concentrations (0.5x,1x,2x,and 4x)group for 3 d. Treg and Th17 value-added ratios were determined by flow cytometry,and the levels of transforming growth factor-β(TGF-β)and interleukin (IL-6,IL-10,IL-17)were measured by cytometric bead array. Results In this study,BMMSCs of P4 generation were uniform in morphology and closely arranged in a shuttle shape,showing small fat droplets in tangerine microscopically after lipogenic induction and black calcium salt nodules microscopically after osteogenic induction. CD90 and CD29 were positively expressed on the surface of BMMSCs and CD45 was weakly expressed. CD4+ T cells were sorted out by magnetic bead method at about (5.75±0.36)×10 cells/ml,with cell purity>95%. After co-culture,the ratio of Treg proliferation was:2x>1x>0.5x>4xconcentration group,with the 2xconcentration group significantly different from all other concentration groups,with statistically significant differences (P<0.05). The ratio of Th17 proliferation was:1x>2x>0.5x>4xconcentration group,with the 0.5x concentration group significantly different from all other concentration groups,and the 4xconcentration group significantly different from 1x and 2x concentration groups,with statistically significant differences (P<0.05). The level of TGF- pwas:1x>2x>4x>0.5xconcentration group,with the Ixconcentration group significantly different from 0.5xand 4xconcentration groups,with statistically significant differences (P<0.05). The level of IL-10 was:2x>1x>4x>0.5x concentration group,with the 0.5x concentration group different from all other concentration groups,with statistically significant differences (P<0.05). There were no statistically significant differences in the levels of IL-6 and IL-17 among each group (P>0.05). Conclusion BMMSCs have multi-lineage differentiation potential,and the proliferation ratio of CD4+ T cells differentiated into Treg and Th17 is affected by the concentration of BMMSCs,with the strongest proliferative effect at relatively high concentrations and inhibition of proliferation at higher concentrations,and the changes in the proliferation ratios of Treg and Th17 are not synchronized with the expression levels of related factors.
[Key words] Bone marrow mesenchymal stem cells;Regulatory T cells;T helper 17 cells;Concentration regulation
骨髓间充质干细胞(bone marrow mesenchymal stem cells,BMMSCs)是存在于骨髓,具有多向分化性及自我增殖能力的一种非造血来源干细胞[1]。间充质干细胞(mesenchymal stem cells,MSCs)在调节免疫细胞增殖、表面受体表达、相关因子分泌等方面具有不可或缺的作用[2]。调节性T细胞(regulatory T cells,Treg)和辅助性T 细胞17(T helper cell 17,Th17)是分别具有抗炎和促炎作用的两类初始CD4+T细胞亚群[3]。Treg/Th17动态平衡是介导自身免疫耐受、维持移植微环境稳态的重要机制,而以Th17为主导的比例失衡及IL-17等,则可致自身免疫病、炎症、移植排斥、肿瘤、代谢异常等的发生[4-5]。根据既往研究,MSCs对Treg/Th17有调控作用。本研究将不同浓度的大鼠BMMSCs同CD4+T细胞共培养,探讨BMMSCs浓度对Treg/Th17表达的影响,以期为BMMSCs在不同条件下的临床运用提供参考。
1 材料与方法
1.1 实验动物
选取SPF级雄性Wistar大鼠[武汉大学动物实验中心,许可证号SCXK (鄂)2008-0004]。在3周龄、约50 g的实验大鼠中提取BMMSCs,选6周龄、约200 g的实验大鼠分选CD4+ T细胞。本实验符合《实验动物管理条例》,且获武汉大学动物实验伦理委员会审批。
1.2 实验材料
青霉素链霉素双抗(美国Hyclone公司,SV30010),Von Kossa染色试剂盒(北京博蕾德生物科技有限公司,HTKMS1001-1),转化生长因子-β(TGF-β)检测试剂盒(上海沪震实业有限公司,HZ-TGF-B1-Mu),胎牛血清(美国Gibco公司,12676029),DMEM/F12 培养基(美国Gibco 公司,12634010),仓鼠抗小鼠CD29 PE (美国BD公司,562801),小鼠抗大鼠CD45 PE-Cy7(美国BD 公司,561588),CD90 APC荧光抗体(上海恪敏生物科技有限公司,SZB17840),IL-6检测试剂盒(上海江莱生物科技有限公司,JL14113),IL-10检测试剂盒(上海江莱生物科技有限公司,JL20242-96T),IL-17检测试剂盒(北京百奥莱博科技有限公司,ZN2653),抗大鼠CD4 FITC荧光抗体[上海艾博抗贸易有限公司,ab269349),大鼠CD4磁珠(德国Melitenyi 公司,130-049-201 ),CO2 培养箱[上海一恒科学仪器有限公司,BPN-50CH(UV)],流式细胞仪(美国BD公司,FACSCanto II)等。
1.3 方法
①提取BMMSCs:剖取3周龄实验大鼠的胫、股骨,将骨髓腔反复洗涤后留取悬液并接种于T75 培养瓶,加入DMEM/F12完全培养液(含1%青霉素链霉素双抗+10%胎牛血清)5 ml后置于培养箱孵育,2~3 d换液1次。贴壁法分离纯化BMMSCs 至90%融合。传代培养至P4代后于倒置显微镜下观察形态并标记CD29、CD90、CD45荧光抗体。流式细胞仪检测细胞纯度。②油红O染色法检测P3代成脂诱导能力:倒去培养液后,先以磷酸盐缓冲液轻缓漂洗,再加入95%酒精固定胞膜30 min,稀释油红储存液,滤纸过滤并静置,除去杂质,染色30 min,75%酒精脱色,除去多余染料,封片。③钙盐染色法检测P3代成骨诱导能力:漂洗同上,加入冷丙醇固定胞膜10 min,蒸馏水冲洗数次,置入孵育液孵育4~6 h,冲洗,2%硝酸钻浸泡4 min,冲洗数次,1%硫化铵浸泡2 min,冲洗,自然干燥、封固。④提取CD4+T细胞:获取6周龄大鼠的脾单个核细胞悬液,计数后将CD4+ T细胞磁珠按比例加入并混匀,将其孵育后置入MS分选柱,缓冲液反复冲刷后获取CD4+T细胞并计数。流式细胞仪检测细胞纯度。⑤共培养:BMMSCs以不同浓度[0.5/1/2/4倍浓度(1/2/4/8×10個/孔)]+培养液置于6孔板孵育。2 d后加入CD4+T细胞(2×10个/孔)及IL-2 (50 mg/L)、植物血凝素(5 g/L),孵育3 d后离心提取上清并冷冻保存。⑥Treg、Th17及相关因子检测:流式细胞仪检测Treg及Th17增殖比例。流式微球分析法检测TGF-B、IL-10、IL-17、IL-6 水平。
1.4 统计学方法
2 结果
2.1 细胞形态学结果
倒置显微镜下P4代BMMSCs形态均匀,且呈梭形紧密排列,符合实验要求所需。经成脂诱导后镜下呈现橘红色脂肪小滴。经成骨诱导后镜下呈现黑钙盐结节。见图1 ~ 3。
2.2 BMMSCs表面抗原检测结果
CD90、CD29于细胞表面阳性表达,CD45弱表达,符合实验要求所需,见图4。
2.3 CD4+ T细胞鉴定
磁珠法分选出CD4+T细胞约(5.75±0.36)×10个/ml,见图5。细胞纯度>95%。符合实验要求所需。
2.4 BMMSCs浓度对Treg/Th17表达的影响
共培养后,在Treg增殖比例上,2倍>1倍>0.5倍>4倍浓度组,2倍浓度组与其他各组组间比较,差异均有统计学意义(P<0.05)。在Th17增殖比例上,1倍>2倍>0.5倍>4倍浓度组,0.5倍浓度组与各组组间比较,4倍浓度组与1倍、2倍浓度组比较,差异均有统计学意义(P<0.05)。见图6~7。
2.5 BMMSCs浓度调节Treg/Th17表达对相关因子水平的影响
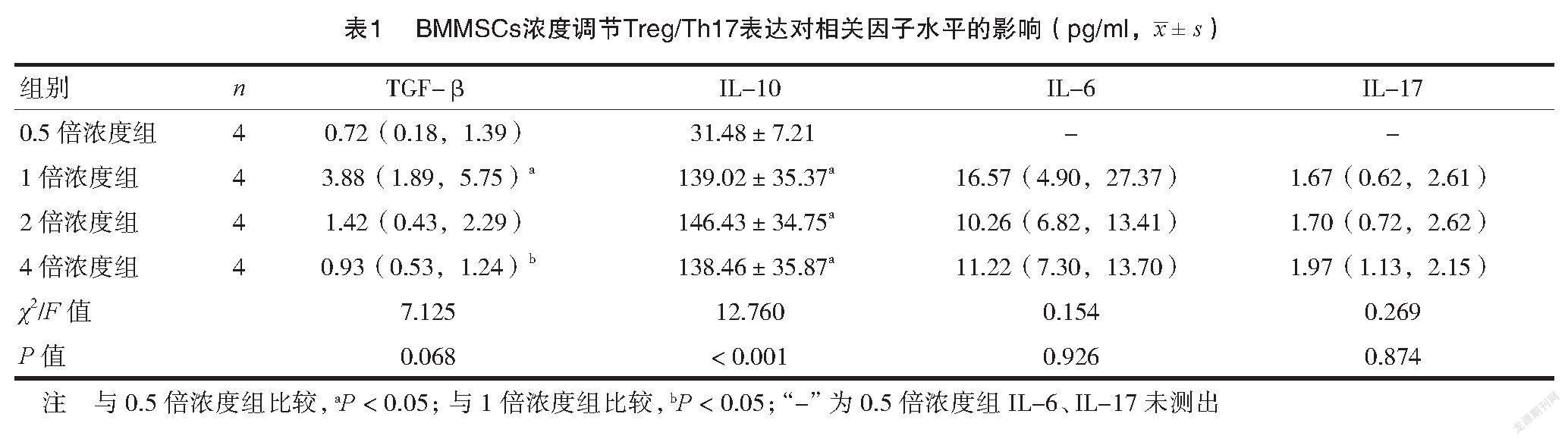
共培养后,在TGF-B水平上,1倍>2倍>4倍>0.5倍濃度组,1倍浓度组与0.5倍、4倍浓度组组间比较,差异均有统计学意义(P<0.05)。在IL-10水平上,2倍>1倍>4倍>0.5倍浓度组,0.5倍浓度组与其他各组比较,差异均有统计学意义(P<0.05)。在IL-6、IL-17水平上,各组组间比较,差异均无统计学意义(P>0.05)。见表1。
3 讨论
BMMSCs在幼稚CD4+T细胞的增殖、分化中意义重大,Treg与Th17是其中影响较大的两类细胞[6]。两者均于TGF-B信号的调控下完成初始分化,但于终末分化阶段,Treg在细胞核内分泌TGF-B、IL-10等抑炎因子,介导免疫逃逸,保持免疫稳态;Th17分泌IL-17、IL-6等致炎因子,诱导自身免疫及炎症反应[7]。既往研究[8-9]亦证实,Treg/Th17比例及其相关细胞因子失衡与某些疾病的发生及其病情程度显著相关。
BMMSCs具有多项分化潜能。本研究提取大鼠BMMSCs与CD4+ T细胞,观察显示,BMMSCs形态均匀,且呈梭形紧密排列,成脂诱导后镜下呈现橘红色脂肪小滴,成骨诱导后镜下呈现黑钙盐结节。说明BMMSCs增殖旺盛,且具有成脂及成骨分化潜能。来源于骨髓、羊水、脂肪等组织中的MSCs 一般可在其表面阳性表达CD90、CD73、CD29等,弱表达CD14、CD45等。本研究BMMSCs表面阳性表达CD90、CD29,弱表达CD45,CD4+T细胞纯度>95%。证明所得细胞符合实验所需。
本研究共培养后,在Treg增殖比例上,2倍>1倍>0.5倍>4倍浓度组,2倍浓度组与其他各组比较,差异有统计学意义(P<0.05)。在Th17增殖比例上,1倍>2倍>0.5倍>4倍浓度组,0.5倍浓度组与各组组间比较,4倍浓度组与1倍、2倍浓度组比较,差异有统计学意义(P<0.05)。在TGF-β水平上,1倍>2倍>4倍>0.5倍浓度组,1倍浓度组与0.5倍、4倍浓度组组间比较,差异有统计学意义(P <0.05)。在IL-10水平上,2倍>1倍>4倍>0.5倍浓度组,0.5倍浓度组与其他各组比较,差异有统计学意义(P <0.05)。在IL-6、IL-17水平上,各组组间比较,差异无统计学意义(P >0.05)。提示BMMSCs可促进Treg、Th17的增殖、分化,但其浓度梯度与Treg/Th17增殖比例不呈正相关。具体表现为,低浓度(0.5倍)时,两者即可增殖,且Th17增殖高峰稍早于Treg;较高浓度(1倍、2倍)时,两者增殖效应最强,高倍浓度(4倍)时,两者增殖比例均显著降低,起抑制作用。而在Treg/Th17平衡对相关因子表达的影响上,相关因子水平与Treg/Th17增殖比例的变化并不同步,且IL-6、IL-17水平变化并不显著。这可能与TGF-B、IL-10等抑炎因子在BMMSCs调节下显著增殖有关[10]。
BMMSCs免疫调节的发挥是多机制的,除TGF-B/Smad 信号通路,Toll受体(Toll-like receptor,TLR)信号通路在先天免疫细胞的激活中亦具重要地位,其可通过自身TLR-3、TLR-4的激活诱导CD4+ CD25+T细胞特征性表达FoxP3蛋白使Treg表达上调,进而发挥免疫抑制作用,当TLR 基因沉默,则分化受抑[11]。此外,TLR亦在不同条件或病模下对Th17分化产生影响。李凌云[12]敲除心脏移植小鼠TLR2基因的研究表明,敲除TLR2可上调Th-17、IL-17、IL-6表达,加重小鼠排异反应。张皓旻等[13]的研究指出,TLR可通过Th17信号通路诱使TNF、IL-6等细胞因子表达上调及自身抗体生成以介导自身免疫应答等。Najar等[14]对BMMSCs的研究中,Treg增殖时,IL-10水平随之上升。Kim等[15]在Th0与BMMSCs的培养体系中阻断IL-10信号通路,结果显示Th17及IL-17比例升高。以上研究共同提示,BMMSCs调节Treg/Th17 平衡机制的实现,可能与其促进Treg及其相关因子增殖、抑制Th17及其相关因子分泌有关。
综上,BMMSCs具多向分化潜能,CD4+T细胞分化成Treg、Th17的增殖比例受到BMMSCs浓度的影响,较高浓度时增殖效应最强,高浓度时抑制增殖,两者增殖比例变化与相关因子表达水平并不同步。
[参考文献]
[1]朱业淘,刘阳,王童.碱性成纤维细胞生长因子修饰骨髓间充质干细胞后对脑出血后神经功能影响的研究进展[J].中国医药科学,2021,11 (6):38-41.
[2]郭礼妍,赖沛龙,耿素霞,等.人脐带间充质干细胞来源外泌体对Treg和TH17细胞的调节作用[J]. 中国实验血液学杂志,2019,27(1):221-226.
[3]崔换天,蔡雨孜,王丽,等.Treg/Th17代谢特点及相关通路对Treg/Th17平衡的影响[J].中国免疫学杂志,2019,35(7):888-891.
[4] Calcaterra V,Croce S,Inci F,et al. Th17 and Treg Balance in Children With Obesity and Metabolically Altered Status[J].Front Pediatr,2020,19 (8):591012.
[5]鄭雅.MicroRNA调控Th17/Treg平衡的研究进展[J]. 医学研究生学报,2020,33 (6):651-657.
[6] Feng Z,Zhai Y,Zheng Z,et al.Loss of A20 in BMMSCs regulates the Th17/Treg balance in Rheumatoid Arthritis[J].Sci Rep,2018,8(1):427.
[7] Lee GR.The Balance of Th17 versus Treg Cells in Autoimmunity[J].Int J Mol Sci,2018,19(3):730.
[8] Moaaz M,Youssry S,Elfatatry A,et al.Th17/Treg cells imbalance and their related cytokines (IL-17,IL-10 and TGF-β)in children with autism spectrum disorder[J].J Neuroimmunol,2019,15 (337):577071.
[9] Rezalotfi A,Ahmadian E ,Aazami H,et al.Gastric Cancer Stem Cells Effect on Th17/Treg Balance;A Bench to Beside Perspective[J].Front Oncol,2019,5 (9):226.
[10]王凯,李亚光,周春雷,等.不同浓度骨髓间充质干细胞对大鼠Treg/Th17平衡的影响[J].中华危重病急救医学,2019,31 (3 ):288-292.
[11] Toubi E,Vadasz Z.Highlights in Autoimmunity:2020[J]. Isr Med Assoc J,2020,11(22):717-719.
[12]李凌云.TLR2基因敲除对小鼠心脏移植排斥反应的影响及机制[D].武汉:华中科技大学,2019:3-4.
[13]张皓旻,杨波,迟小华,等.SARS病毒感染相关免疫损伤分子机制和干预药物的生物信息学预测及其对COVID-19的意义[J].中华微生物学和免疫学杂志,2020,40(3):165-173.
[14] Najar M ,Raicevic G,Fayyad-Kazan H,et al. Mesenchymal stromal cells and immunomodulation:A gathering of regulatory immune cells [J]. Cytotherapy,2016,18(2):160-171.
[15] Kim N,Cho SG.Overcoming immunoregulatory plasticity of mesenchymal stem cells for accelerated clinical applications [J]. Int J Hematol,2016,103 (2):129-137.





