廖锦钰 黄莉萍 张战泓 张德咏 谭新球 刘勇 史晓斌

摘要 :番茄褪绿病毒Tomato chlorosis virus(ToCV)是一种由烟粉虱Bemisia tabaci传播的正义单链RNA病毒,在田间常与番茄黄化曲叶病毒Tomato yellow leaf curl virus(TYLCV)复合侵染而造成番茄生产上重大的经济损失。为了明确ToCV与TYLCV的复合侵染对烟粉虱传播ToCV所造成的影响,本文采用RT-PCR以及qRT-PCR检测了复合侵染的番茄对烟粉虱获取和传播ToCV的影响。研究表明,烟粉虱取食复合侵染的番茄后对ToCV的传播效率显著提高,仅25头烟粉虱的传毒率即可达到100%,ToCV在烟粉虱以及番茄体内的累积量均显著提高。说明这种复合侵染促进了烟粉虱对ToCV的传播,在田间应当及时防控烟粉虱,警惕病毒与烟粉虱的蔓延。
关键词 :番茄褪绿病毒; 番茄黄化曲叶病毒; 烟粉虱; 复合侵染
中图分类号:
S 436.412.11
文献标识码:
A
DOI:
10.16688/j.zwbh.2020063
Influence of co-infection of Tomato chlorosis virus and Tomato yellow
leaf curl virus on the transmission of Tomato chlorosis virus
LIAO Jinyu1,2, HUANG Liping1,2, ZHANG Zhanhong3, ZHANG Deyong2, TAN Xinqiu2, LIU Yong2*, SHI Xiaobin1,2*
(1. Subcollege of Longping, Graduate School of Hunan University, Changsha 410128, China;
2. Hunan Plant Protection Institute, Hunan Academy of Agricultural Sciences, Changsha 410125, China;
3. Hunan Vegetable Institute, Hunan Academy of Agricultural Sciences, Changsha 410125, China)
Abstract
Tomato chlorosis virus (ToCV) is a positive single-stranded RNA virus transmitted by Bemisia tabaci, which is usually co-infected with Tomato yellow leaf curl virus (TYLCV) in the field and causes significant economic losses in tomato production. In order to clarify the influence of co-infection of ToCV and TYLCV on the transmission of ToCV, RT-PCR and real-time quantitative PCR were used to detect the effect of co-infection on the virus acquisition and transmission of ToCV by B.tabaci. The results showed that the ToCV transmission efficiency was significantly improved after co-infection. Only 25 B.tabaci individuals could cause a 100% transmission rate, and the quantities of ToCV in B.tabaci and tomato were significantly increased. This co-infection promoted the spread of ToCV by B.tabaci. The whitefly should be prevented timely, and the spread of virus and whitefly should be highly regarded in the field.
Key words
Tomato chlorosis virus; Tomato yellow leaf curl virus; Bemisia tabaci; co-infection
番茄褪绿病毒Tomato chlorosis virus (ToCV),隶属于长线性病毒科Closteroviridae,毛形病毒属Crinivirus,是一种由烟粉虱Bemisia tabaci传播的半持久性RNA病毒,于2004年在我国台湾首次报道[1]。番茄黄化曲叶病毒Tomato yellow leaf curl virus (TYLCV),隶属于双生病毒科Geminiviridae,菜豆金色花叶病毒属Begomovirus,是一种单链环状DNA植物病毒,田间依靠烟粉虱以持久性非增殖方式传播,于2006年在我国上海首次报道[2]。ToCV与TYLCV的发病时期和所需的环境条件大致相同,傳播媒介相似,发病症状均表现为叶片黄化,其主要区别在于ToCV通常表现为老叶先发病,叶片脉间黄化褪绿,同时变厚变脆且边缘向内卷曲;而TYLCV通常表现为新叶先发病,叶缘逐渐黄化,同时变小皱缩且向上卷曲[34]。此外,ToCV与TYLCV发病的潜伏期差异较大,ToCV的潜伏期较长,一般需要3~4周才能表现出症状,而TYLCV的潜伏期较短,一般7~10 d就开始表现发病症状[34]。ToCV在田间极易与TYLCV复合侵染,TYLCV和ToCV的复合侵染于2014年首次在山东发现,随后在江苏和云南相继报道并且呈逐年上升趋势[57]。据统计,从2013年至2017年,TYLCV的检出率在全国番茄病毒中排名第3,ToCV已经成为北京及山东地区侵染番茄的优势种[8],TYLCV与ToCV均能给番茄造成10%以上的减产幅度,严重时甚至绝收[4,910],给我国番茄生产造成严重的经济损失。
病毒的复合侵染往往会产生协生作用,对寄主植物造成不可估量的伤害。已有大量研究表明,病毒的复合侵染会提高病毒的致病性,造成更为严重的发病症状,从而加速寄主植物死亡[1113]。复合侵染还能增加病毒发生基因重组的几率,进而产生具有更强致病力和更广寄主范围的新病毒[1416]。目前对于ToCV与TYLCV复合侵染的研究主要以分子鉴定以及病害流行为主,二者复合侵染后对寄主植物的影响以及其与介体昆虫相互作用的研究较少,本文重点研究了TYLCV和ToCV复合侵染番茄对烟粉虱的获毒能力和传毒率以及ToCV在烟粉虱和番茄体内累积量的影响,从而明确复合侵染是否影响烟粉虱对ToCV的传播,为研究TYLCV和ToCV复合侵染后二者的协生作用及其分子机制奠定基础,也为ToCV及TYLCV的防控策略提供新思路。
1 材料与方法
1.1 试验材料
供试毒源:ToCV单独侵染、ToCV与TYLCV复合侵染的番茄采自山东寿光,并且经过PCR以及小RNA测序检测无其他病毒复合侵染。将毒株移栽至湖南省农业科学院植物保护研究所温室,在不同隔间中单独培养,分别采用虫传的方法获取毒株:取健康Q型烟粉虱用带毒番茄喂饲48 h以获得携带ToCV和携带ToCV与TYLCV的烟粉虱,经随机取样检测确认带毒后,用微虫笼转移带毒烟粉虱至3~4片真叶期的健康番茄上,每株番茄接种50头,取食48 h后移除烟粉虱,30 d后取番茄植株最上部的叶片,采用1.2中RT-PCR法检测传毒是否成功。每月定期虫传,以保证毒株的供应。
供试植株:番茄品种为‘中杂9号(Lycopersicon esculentum ‘Zhongza 9),于温室内培育,(26±1)℃、RH(70±5)%、光周期L∥D=16 h∥8 h,未接触任何农药和昆虫。
供试昆虫:Q型烟粉虱,由中国农业科学院蔬菜花卉研究所张友军研究员课题组馈赠,饲喂于番茄植株上,之后放在养虫笼内用无虫番茄继代饲养,每隔两个月进行生物型鉴定[17]。
1.2 番茄与烟粉虱带毒情况检测
1.2.1 番茄中ToCV的鉴定
采用RT-PCR法检测番茄ToCV的感染情况,采用华越洋多糖多酚植物RNA提取试剂盒按照说明书步骤提取番茄总RNA。cDNA合成使用南京诺维赞(Vazyme)生物公司Hiscript Ⅱ 1st Strand cDNA Synthesis Kit (+gDNA wiper),按照说明书步骤合成cDNA用作RT-PCR模板。
以表1中ToCV-3F/ToCV-3R为特异性引物,使用南京诺维赞(Vazyme)生物公司2×Taq Plus Master MixⅡ (Dye Plus)试剂盒,按照说明书步骤进行PCR扩增。PCR产物经1%琼脂糖凝胶电泳检测,在凝胶成像系统上观察并记录结果,目的条带经纯化回收后送生工生物工程(上海)股份有限公司测序分析。
1.2.2 番茄中TYLCV的鉴定
采用PCR法检测番茄TYLCV的感染情况。用CTAB法提取番茄总DNA。以表1中TYLCV-F/TYLCV-R为特异性引物,使用2×Taq Plus Master Mix Ⅱ (Dye Plus)试剂盒,按照说明书步骤进行PCR扩增。PCR产物经1%琼脂糖凝胶电泳检测,在凝胶成像系统上观察并记录结果,目的条带经纯化回收后送生工生物工程(上海)股份有限公司测序分析。
1.2.3 烟粉虱中ToCV的鉴定
烟粉虱RNA提取采用TRIzol (Invitrogen公司)法,将烟粉虱样品置于RNase free 的1.5 mL 离心管中,用液氮冷冻后研磨,参照说明书提取总RNA,后续鉴定步骤参照1.2.1。
1.3 番茄褪绿病毒SYBR Green I 实时荧光定量PCR体系建立
本试验采用高利利建立的番茄褪绿病毒SYBR Green I 实时荧光定量 PCR 体系[18],基于ToCV RNA2链的HSP70基因保守区设计引物ToCV-qF和ToCV-qR(表1),目的片段长度为190 bp,经验证该引物特異性及扩增效率良好。
1.3.1 ToCV基因片段克隆与鉴定
以ToCV的反转录cDNA为模板,以ToCV-qF和ToCV-qR为引物,使用2×Taq Plus Master Mix Ⅱ (Dye Plus)试剂盒进行PCR扩增,得到190 bp目的条带,使用Gel Extration Kit回收试剂盒(OMEGA生物公司)纯化回收目的片段,连接至pMD18-T Vector(TaKaRa),并转化感受态细胞TreliefTM5α Chemically Competent Cell(北京擎科生物有限公司),37℃过夜培养后,以ToCV-qF和ToCV-qR为引物进行菌落PCR检测,将阳性克隆送至上海生物工程有限公司测序。
1.3.2 ToCV质粒标准品的制备
选择测序序列完全正确的阳性克隆接种于含有氨苄青霉素(100 mg/L Amp+)的LB液体培养基,37℃,250 r/min 培养过夜,提取质粒,利用紫外分光光度计检测质粒浓度及OD值后保存至-20℃。运用公式:C=A/B×6.02×1023(A 为质粒浓度g/μL,B为质粒DNA分子量,C为质粒浓度拷贝/μL)计算出质粒浓度拷贝数,将其作为ToCV质粒标准品使用。
1.3.3 标准曲线的建立
将质粒标准品用DNase/RNase free water(天根生化科技有限公司)按照10倍梯度进行稀释,获得终浓度为1.1×105~1.1×1011 拷贝/μL的7个质粒样品,使用南京诺维赞(Vazyme)生物公司qRT-PCR试剂盒按照说明书在实时荧光定量PCR仪(BioRad CFX96梯度荧光定量PCR仪,伯乐,美国)上进行qRT-PCR,每个浓度进行3次技术重复,仪器自动生成标准曲线。
1.4 复合侵染对烟粉虱获取ToCV效率的影响
分别取80头无毒健康、初羽化的烟粉虱,饥饿处理2 h后转移至经测定ToCV病毒量相近的复合侵染和ToCV单独侵染30 d后的番茄上,饲毒48 h后,随机取10头烟粉虱提取单头烟粉虱的RNA,采用1.2.3所述方法检测其带毒情况,并计算单头烟粉虱的帶毒率,重复5次。
1.5 复合侵染对烟粉虱体内ToCV累积量的影响
分别取80头无毒健康、初羽化的烟粉虱,饥饿处理2 h后转移至经测定ToCV病毒含量相近的复合侵染和ToCV单独侵染30 d后的番茄上,饲毒48 h后,随机取10头烟粉虱参照1.2.3方法提取总RNA,统一定量为500 ng且严格控制RNA质量(A260/A280为1.8~2.1),反转录后进行qRT-PCR检测,同时按照1.3.2方法建立回归方程,将得到的Ct值带入回归方程算出ToCV的拷贝数,每个处理重复5次。
1.6 复合侵染对ToCV传毒率的影响
取适量无毒健康、初羽化的烟粉虱,饥饿处理2 h后转移至ToCV病毒含量相近的复合侵染和ToCV单独侵染的番茄上饲毒48 h,用微虫笼转移不同数量(5、10、25、50头)的带毒烟粉虱至3~4片真叶期的健康番茄上,48 h后移除烟粉虱,30 d后采用1.2.1所述方法检测其带毒情况,并计算发病率。每个处理用10株番茄苗,每个处理重复5次。
1.7 复合侵染对番茄体内ToCV累积量的影响
取适量无毒健康、初羽化的烟粉虱,饥饿处理2 h后转移至ToCV病毒含量相近的复合侵染和ToCV单独侵染的番茄上饲毒48 h,用微虫笼转移50头带毒烟粉虱至3~4片真叶期的健康番茄上,48 h后移除烟粉虱,30 d后取番茄顶部叶片参照121方法提取总RNA,统一定量为500 ng且严格控制RNA质量(A260/A280为1.8~2.1),反转录后进行qPCR检测,同时按照1.3.2方法建立回归方程,将得到的Ct值带入回归方程算出ToCV的拷贝数,每个处理重复5次。
1.8 数据处理
所有数据均采用Microsoft Excel 2010软件记录并整理试验结果,采用IBM SPSS Statistics 19软件进行分析,其中复合侵染对烟粉虱获取ToCV的获毒率影响、复合侵染对烟粉虱体内ToCV病毒量的影响以及复合侵染对番茄体内ToCV病毒量的影响均采用独立样本t测验(t-test)进行方差分析和差异显著性检验;复合侵染对ToCV传毒率的影响从两个方面进行分析:在相同烟粉虱数量时,两种侵染方式的番茄带毒率进行独立样本t测验(t-test);在相同侵染方式下,不同数量的烟粉虱传毒后番茄的带毒率进行单因素方差分析(One-way ANOVA)。
2 结果与分析
2.1 番茄褪绿病毒SYBR Green I实时荧光定量PCR体系建立
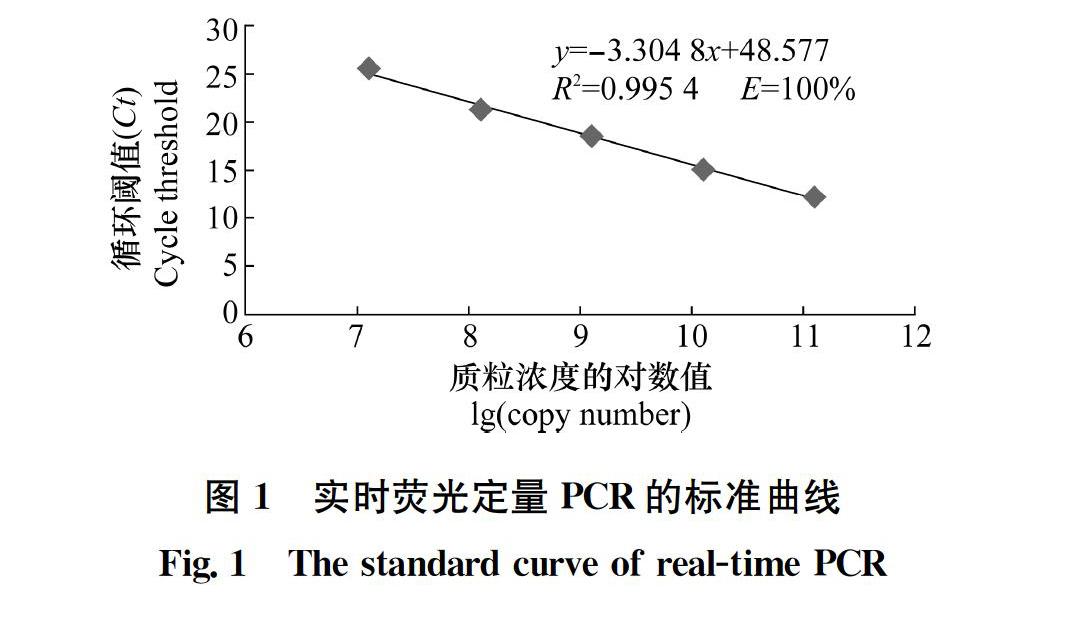
在质粒标准品浓度为1.1×105~1.1×109 拷贝/μL范围内,Ct 值与质粒标准品浓度之间呈现出良好的线性关系(图1),标准曲线斜率为-3.304 8,决定系数R2=0.995 4,扩增效率为100%,直线方程为y=-3.304 8x+48.577。该标准曲线可用于后续ToCV含量的测定。
2.2 复合侵染对烟粉虱获取ToCV效率的影响
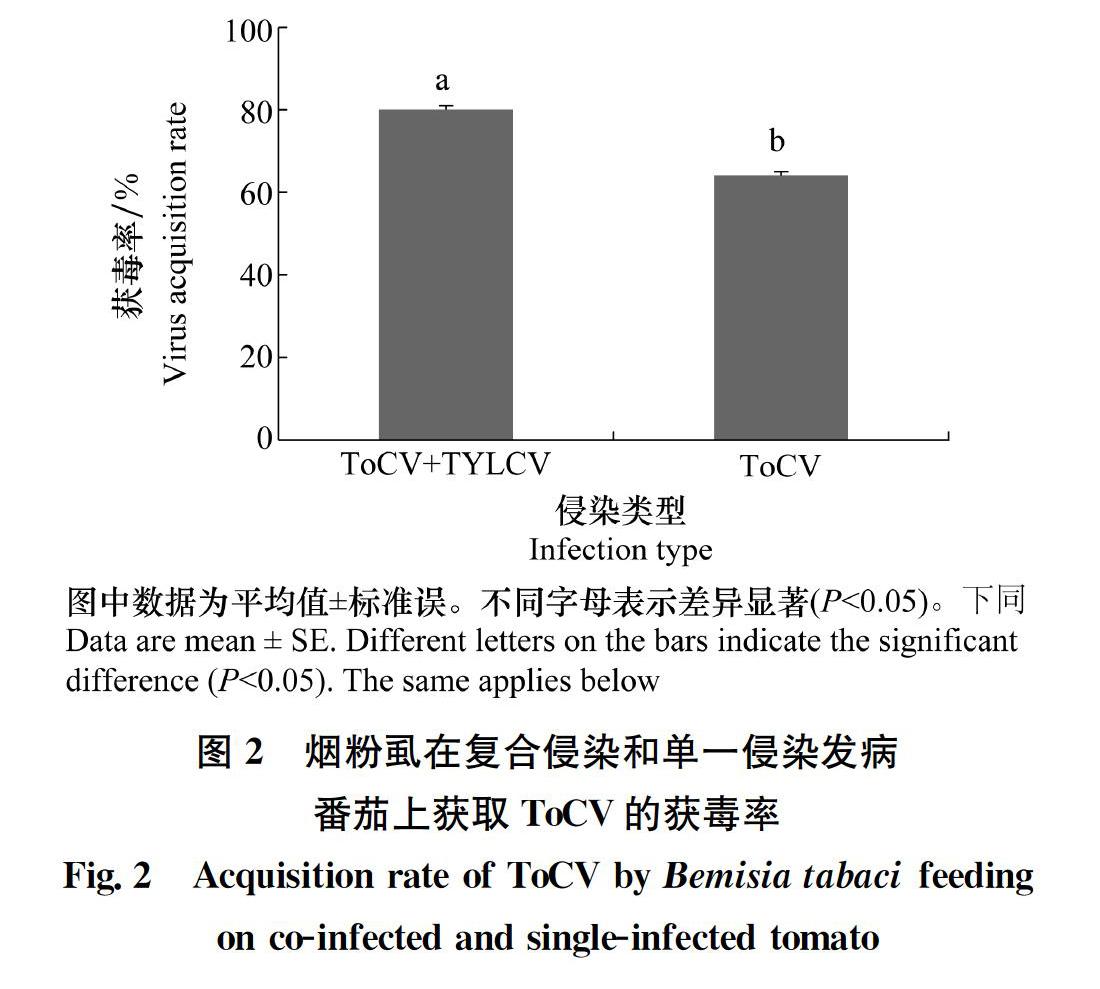
在复合侵染番茄上饲毒48 h后单头烟粉虱带毒率为80%,显著高于在ToCV单独侵染番茄上饲毒48 h后单头烟粉虱的带毒率64%(图2)。
2.3 复合侵染对烟粉虱体内ToCV积累量的影响
烟粉虱在ToCV单独侵染的番茄植株上取食48 h后,体内ToCV病毒拷贝数为1.59×107拷贝/μL,而在复合侵染番茄植株上取食48 h后,体内ToCV病毒拷贝数为6.79×107拷贝/μL,约为前者的4倍(图3)。
2.4 复合侵染对ToCV传毒率的影响
取食复合侵染和单独侵染的番茄后,烟粉虱对ToCV的传毒率均随烟粉虱数量增加呈上升趋势,其中,取食复合侵染的番茄后,10头烟粉虱对ToCV的传毒率可达到55%,25头烟粉虱的传毒率接近100%,而取食ToCV单独侵染的番茄后,10头和25头烟粉虱对ToCV的传毒率均低于80%。烟粉虱数量相同时,从复合侵染番茄上获毒后对ToCV的传毒率均显著高于从单独侵染的番茄上获毒的烟粉虱的传毒率,烟粉虱数量为50头时,从复合侵染或单独侵染番茄上获毒后对ToCV的传毒率均可达到100%(图4)。
2.5 复合侵染对番茄体内ToCV累积量的影响
取食复合侵染和ToCV单独侵染番茄的烟粉虱传毒后,番茄体内ToCV的累积量增长情况如图5所示。传毒30 d后,接种ToCV的番茄体内ToCV累积量为1.40×109拷贝/μL,而复合侵染的番茄体内ToCV的累积量达到了7.68×109拷贝/μL,比单独接种ToCV的番茄高约4倍。
3 讨论
在田间一种植物可以感染多种病毒,并且很多复合侵染的病毒均由一种介体昆虫传播,例如ToCV与TYLCV均由烟粉虱传播。近年来,我国TYLCV与ToCV的复合侵染呈逐年上升趋势[57],而ToCV的发生也由局部地区逐渐向全国扩张[4,8,1921]。本试验重点研究了ToCV和TYLCV复合侵染是否影响媒介昆虫烟粉虱对ToCV的获取和传播,发现烟粉虱取食ToCV与TYLCV复合侵染的番茄植株48 h后,单头烟粉虱的ToCV带毒率以及ToCV累积量显著高于取食ToCV单独侵染番茄的烟粉虱,这表明ToCV与TYLCV的复合侵染提高了烟粉虱对ToCV的获取能力。烟粉虱取食复合侵染的番茄后对ToCV的传播效率明显增加,25头烟粉虱的传毒效率接近100%,这可能是由于取食复合侵染番茄的烟粉虱获得了更高的带毒率以及带毒量。植物病毒可以通过与其媒介昆虫体内的某些蛋白互作来影响自身的传播,例如前期研究发现ToCV能与烟粉虱的嗅觉蛋白OBP3互作,通过影响烟粉虱对植物的选择性来操控烟粉虱传毒[22],本研究发现携带两种病毒后烟粉虱获取和传播ToCV的能力显著提高,可能是由于同时携带两种病毒的烟粉虱体内某种与ToCV互作的蛋白活性发生了变化。此外,有研究发现携带TYLCV的烟粉虱能够通过抑制植物茉莉酸防御途径,激活挥发物新植二烯的产生而促进病毒传播[23],结合我们的研究可以推测,同时携带TYLCV和ToCV的烟粉虱可能抑制了某种植物防御途径,而这种防御途径是对抗ToCV侵染的有效途径。该推测还需要进一步的试验验证。在大田环境下,ToCV和TYLCV的复合侵染经常发生,同时伴随着大量烟粉虱在田间繁殖。本研究从复合侵染的植物入手,解析了近年来ToCV在我国迅速扩散传播的原因。本研究只研究了复合侵染对烟粉虱传播ToCV的影响,下一步还需要继续研究复合侵染对烟粉虱传播TYLCV的影响。
ToCV能与多种病毒发生复合侵染,如番茄斑萎病毒Tomato spotted wilt virus (TSWV)、凤果花叶病毒Pepino mosaic virus (PMV)等[2425]。在病毒的协生作用中,一种病毒激发另一种病毒增殖的现象非常常见,例如马铃薯Y病毒可以作為激发病毒促进其他异源病毒的复制[2627],TSWV与ToCV复合侵染能够促进ToCV在番茄体内的复制,从而加快寄主植物的死亡[24]。目前为止,大量研究表明复合侵染产生的协生作用是由于其中一种病毒抑制了宿主的防御机制或者促进了病毒在寄主体内的移动,例如,马铃薯A病毒Potato virus A (PVA)与马铃薯卷叶病毒Potato leaf roll virus (PLRV)复合侵染后,PVA的沉默抑制子P1/HC-Pro通过抑制植物抗病毒防御机制导致PLRV在植物体内的积累显著增加,同时观察到PLRV病毒粒子离开韧皮部感染叶肉细胞[28];黄瓜花叶病毒Cucumber mosaic virus (CMV)的2b蛋白能够干扰烟草中限制马铃薯Y病毒Potato virus Y (PVY)传播的防御机制,从而导致二者复合侵染后PVY能够侵染所有烟草组织[29]。本研究发现,从复合侵染的番茄上获毒的烟粉虱传毒30 d后,感病番茄体内ToCV的累积量显著高于从ToCV单独侵染的番茄上获毒后再侵染的番茄,这表明在复合侵染的过程中,TYLCV很可能作为激发病毒促进ToCV在番茄植株内的增殖,或者TYLCV的某种蛋白干扰了番茄体内限制ToCV传播的防御机制,从而促进了ToCV在番茄体内的移动。复合侵染时病毒之间的互作极其复杂,涉及到病毒与病毒、病毒与环境、病毒与寄主间的相互作用,不同寄主、温度、光照以及病毒侵染的次序和浓度都会影响协生作用[30],对于ToCV与TYLCV复合侵染番茄后二者在番茄体内的互作还需要进一步研究。
本研究发现ToCV和TYLCV的复合侵染促进了烟粉虱对ToCV的传播,这将导致ToCV的进一步扩散和蔓延。因此,明确复合侵染情况下病毒与媒介昆虫互作以及病毒协生作用的分子机制,对植物病毒病的防治具有重要意义,同时在田间应该及时防治烟粉虱,以减少烟粉虱对病毒的传播。
参考文献
[1] TSAI W S, SHIH S L, GREEN S K, et al. First report of the occurrence of Tomato chlorosis virus and Tomato infectious chlorosis virus in Taiwan[J]. Plant Disease, 2004, 88(3):
311.
[2] WU Jianbo, DAI Fuming, ZHOU Xueping. First report of Tomato yellow leaf curl virus in China [J]. Plant Disease, 2006, 90(10):
1359.
[3] 刘剑峰, 肖启明, 张德咏, 等. 番茄黄化曲叶病(TYLCV)的研究进展[J]. 中国农学通报, 2013, 29(13):
7076.
[4] 刘永光, 魏家鹏, 乔宁, 等. 番茄褪绿病毒在山东暴发及其防治措施[J]. 中国蔬菜, 2014(5):
6769.
[5] 赵黎明, 李刚, 刘永光, 等. 番茄褪绿病毒与番茄黄化曲叶病毒复合侵染的分子鉴定[J]. 中国蔬菜, 2014(12):
1520.
[6] 吴淑华, 李廷芳, 赵文浩, 等. 江苏省番茄黄化曲叶病毒和褪绿病毒复合侵染的分子检测[J]. 园艺学报, 2016, 43(1):
8999.
[7] 刘微, 史晓斌, 唐鑫, 等. 云南番茄褪绿病毒和番茄黄化曲叶病毒复合侵染的分子鉴定[J]. 园艺学报, 2018, 45(3):
552560.
[8] 刘勇, 李凡, 李月月, 等. 侵染我国主要蔬菜作物的病毒种类、分布与发生趋势[J]. 中国农业科学, 2019, 52(2):
239261.
[9] 贺志军, 姚贵军, 乔宏喜, 等. 设施番茄黄化曲叶病毒病发生规律与综合防控措施[J]. 西北园艺(蔬菜), 2016(6):2831.
[10]王书芳. 河北魏县番茄黄化曲叶病毒病的发生情况及其综合防控措施[J]. 中国植保导刊, 2011, 31(2):
2425.
[11]KARYEIJA R F, KREUZE J F, GIBSON R W, et al. Synergistic interactions of a potyvirus and a phloem-limited crinivirus in sweet potato plants [J]. Virology, 2000, 269(1):
2636.
[12]VALKONEN J P T, SAVENKOV E I. Potyviral helper-component proteinase expressed in transgenic plants enhances titers of Potato leaf roll virus but does not alleviate its phloem limitation [J]. Virology, 2001, 283(2):
285293.
[13]VANCE V B. Replication of Potato virus X RNA is altered in coinfections with Potato virus Y [J]. Virology, 1991, 182(2):
486494.
[14]GIL-SALAS F M, PETERSB J, BOONHAMB N, et al. Co-infection with Cucumber vein yellowing virus and Cucurbit yellow stunting disorder virus leading to synergism in cucumber [J]. Plant Pathology, 2012, 61(3):
468478.
[15]OWOR B E, MARTIN D P, SHEPHERD D N, et al. Genetic analysis of maize streak virus isolates from Uganda reveals widespread distribution of a recombinant variant [J]. Journal of General Virology, 2007, 88(11):
31543165.
[16]DAVINO S, NAPOLI C, DELLACROCE C, et al. Two new natural begomovirus recombinants associated with the tomato yellow leaf curl disease co-exist with parental viruses in tomato epidemics in Italy [J]. Virus Research, 2009, 143(1):
1523.
[17]SHI Xiaobin, CHEN Gong, TIAN Lixia, et al. The salicylic acid-mediated release of plant volatiles affects the host choice of Bemisia tabaci [J]. International Journal of Molecular Sciences, 2016, 17(7):
1048.
[18]高利利. 番茄褪绿病毒的分子鉴定及荧光定量PCR检测体系的建立与应用[D]. 泰安:
山东农业大学, 2016.
[19]ZHAO Liming, LI Gang, GAO Ying, et al. Molecular detection and complete genome sequences of Tomato chlorosis virus isolates from in factious outbreaks in China [J]. Journal of Phytopathology, 2014, 162(10):
627634.
[20]郑慧新, 夏吉星, 周小毛, 等. 警惕烟粉虱传播的番茄褪绿病毒病在我国快速扩散[J]. 中国蔬菜, 2016(4):
2226.
[21]王雪忠, 张战泓, 郑立敏, 等. 番茄褪绿病毒在湖南省首次发生[J]. 中国蔬菜, 2018(8):
2731.
[22]SHI Xiaobin, WANG Xuezhong, ZHANG Deyong, et al. Silencing of odorant-binding protein gene OBP3 using RNA interference reduced virus transmission of Tomato chlorosis virus [J/OL]. International Journal of Molecular Science, 2019, 20(20):
4969.DOI:
10.3390/ijms20204969.
[23]SHI Xiaobin, PREISSER E L, LIU Baiming, et al. Variation in both host defense and prior herbivory can alter plant-vector-virus interactions [J/OL]. BMC Plant Biology, 2019, 19:
556.DOI:10.1186/s128700192178z.
[24]GARCIA-CANO E, RESENDE R O, FERNANDEZ-MUNOZ R, et al. Synergistic interaction between Tomato chlorosis virus and Tomato spotted wilt virus results in breakdown of resistance in tomato [J]. Phytopathology, 2006, 96(11):
12631269.
[25]ALFARO-FERNANDEZ A, MEDINA V, CORDOBA-SELLES M C, et al. Ultrastructural aspects of tomato leaves infected by Tomato chlorosis virus (ToCV) and co-infected by other viruses [J]. Plant Pathology, 2010, 59(2):
231239.
[26]PRUSS G, GE Xin, SHI Xingming, et al. Plant viral synergism:
the potyviral genome encodes a broad-range pathogenicity enhancer that transactivates replication of heterologous viruses [J].The Plant Cell, 1997, 9(6):
859868.
[27]GOODMAN R M, ROSS A F. Enhancement by Potato virus Y of Potato virus X synthesis in doubly infected tobacco depends on the timing of invasion by the viruses [J].Virology, 1974, 58(1):
263271.
[28]SAVENKOV E I, VALKONEN J P T. Potyviral helper-component proteinase expressed in transgenic plants enhances titers of Potato leaf roll virus but does not alleviate its phloem limitation [J].Virology, 2001, 283(2):
285293.
[29]RYANG B S, KOBORI T, MATSUMOTO T, et al. Cucumber mosaic virus 2b protein compensates for restricted systemic spread of Potato virus Y in doubly infected tobacco [J].The Journal of General Virology, 2004, 85(11):
34053414.
[30]魯瑞芳, 李为民, 彭学贤. 植物病毒协生作用及其分子机理[J]. 中国病毒学, 2001, 16(3):
195201.
(责任编辑:杨明丽)