王宏 徐娟 江茜 康利 刘伟伟 袁玲 崔晓雪 刘琳娜 冯仁蕊 王蕾 李燕林


摘 要 目的:研究大黄-丹参药对对慢性肾衰竭(CRF)模型大鼠肠源性尿毒素含量和肠道屏障功能的影响。方法:将55只雄性Wistar大鼠随机分为假手术组(10只)和造模组(45只),假手术组大鼠分离肾组织但不切除,造模组大鼠采用5/6肾切除法复制CRF模型。造模成功后(剔除死亡和不成模大鼠5只),将模型大鼠分为模型组(水)、尿毒清颗粒组(2.5 g/kg)和大黄-丹参药对高、低剂量组(6、3 g/kg,以生药量计),每组10只。假手术组和模型组大鼠灌胃等体积水,各给药组灌胃相应药物,每天1次,连续12周。末次给药后,采用全自动生化分析仪检测各组大鼠血清中肌酐(Scr)、尿素氮(BUN)含量和24 h尿液中尿肌酐(Ucr)含量,并计算肌酐清除率(Ccr);采用超高效液相色谱-电喷雾串联三重四极杆质谱法同时测定大鼠血清中尿毒素[氧化三甲胺(TMAO)、硫酸吲哚酚(IS)、硫酸对甲酚(PCS)]的含量;采用实时荧光定量聚合酶链式反应(RT-PCR)法、免疫荧光法分别检测大鼠回肠组织中闭合蛋白(Occludin)、紧密连接蛋白1(ZO-1)的mRNA和蛋白表达水平;采用苏木素-伊红染色法、Masson染色法观察大鼠肾组织的病理学变化;采用透射电镜法观察大鼠结肠组织的超微结构变化。结果:与假手术组比较,模型组大鼠血清中Scr、BUN、TMAO、PCS、IS含量均显著升高(P<0.01),尿液中Ucr含量和Ccr及回肠组织中Occludin、ZO-1的mRNA及蛋白表達水平均显著降低(P<0.01);肾组织中肾小球硬化、肾小管扩张,肾间质可见炎性细胞浸润和纤维化;结肠上皮屏障结构重度损伤。与模型组比较,各给药组大鼠血清中Scr、BUN、TMAO、PCS、IS含量均显著降低(P<0.05或P<0.01);尿液中Ucr含量和回肠组织中Occludin、ZO-1的mRNA及蛋白表达水平均显著升高(大黄-丹参药对低剂量组的ZO-1 mRNA除外,P<0.05或P<0.01);肾间质炎性细胞浸润、纤维化程度和结肠上皮屏障结构损伤程度均减轻。结论:大黄-丹参药对能有效保护CRF模型大鼠残存的肾功能,其作用机制可能与降低大鼠血清中肠源性尿毒素含量,上调回肠组织中Occludin、ZO-1 的mRNA及蛋白表达水平从而改善肠道屏障功能有关。
关键词 大黄;丹参;慢性肾衰竭;肠源性尿毒素;肠道屏障;大鼠
中图分类号 R285.5 文献标志码 A 文章编号 1001-0408(2021)07-0825-07
ABSTRACT OBJECTIVE:
To study the effects of couplet medicine of Rheum palmatum-Salvia miltiorrhiza on the contents of enterogenous urotoxin and intestinal barrier function in chronic renal failure (CRF) model rats. METHODS:
Totally 55 male Wistar rats were randomly divided into sham operation group (10 rats) and modeling group (45 rats). In sham operation group, the kidneys were isolated but not removed; CRF model was reproduced by 5/6 nephrectomy in modeling group. After modeling (excluding 5 dead and non-modeling rats), modeling rats were divided into model group (water), Niaoduqing granules group (2.5 g/kg),couplet medicine of R. palmatum-S. miltiorrhiza groups (6, 3 g/kg, by crude drug), with 10 rats in each group. Sham operation group and model group were given constant volume of water intragastrically. Administration groups were given relevant medicine intragastrically, once a day, for consecutive 12 weeks. After last administration, the contents of creatinine (Scr) and urea nitrogen (BUN) in serum, the content of urinary creatinine (Ucr) in urine were determined by automatic biochemical analyzer; creatinine clearance rate (Ccr) was calculated. The contents of enterogenous urotoxin [trimethylamine-N-oxide (TMAO), indoxyl sulfate (IS) and p-cresyl sulphate (PCS)] were determined by UPLC-ESI-MS/MS. Real-time RT-PCR and immunofluorescence assay were used to detect the mRNA and protein expression of Occludin and ZO-1 in the ileum tissue. HE staining and Masson staining were used to observe the pathological changes of renal tissue. The ultrastructural changes of rat colon were observed by transmission electron microscope. RESULTS:
Compared with sham operation group, serum contents of Scr, BUN, TMAO, PCS and IS were increased significantly in model group (P<0.01), while urine content of Ucr, Ccr, mRNA and protein expression of Occludin and ZO-1 in ileum tissue were decreased significantly (P<0.01); renal glomerulosclerosis, renal tubules dilation and inflammatory invasion and fibrosisin the interstitium were all found; the intestinal epithelial barrier structure of colon tissue was severely damaged. Compared with model group, serum contents of Scr, BUN, TMAO, PCS and IS were decreased significantly in administration groups (P<0.05 or P<0.01); the mRNA and protein expression of Occludin and ZO-1 in the ileum tissue were increased significantly (except for mRNA expression of ZO-1 in R. palmatum-S. miltiorrhiza low-dose group (P<0.05 or P<0.01); the infiltration of inflammatory cells in renal interstitium, the degree of fibrosis and the damage of intestinal epithelial barrier structure in colon tissue were reduced. CONCLUSIONS:
Couplet medicine of R. palmatum-S. miltiorrhiza can effectively protect the residual renal function of CRF model rats, the mechanism of which may be associated with reducing the serum contents of enterogenous urotoxin, up-regulating mRNA and protein expresssion of Occludin and ZO-1 in the ileum tissue so as to improve intestinal barrier function.
KEYWORDS Rheum palmatum; Salvia miltiorrhiza; Chronic renal failure; Enterogenous urotoxins;Intestinal barrier; Rats
慢性肾衰竭(Chronic renal failure,CRF)多发生于各种慢性肾病后期,表现为不可逆的进行性肾功能损害[1]。其发病率高、预后差、并发症复杂,已成为全球重大公共卫生问题[2]。因此,如何采取有效措施延缓CRF的进展并防止并发症的出现,是临床亟需解决的难题。“肠-肾轴”理论[3]阐述了CRF中肾与肠道在病理上的密切关系,指出肠道菌群紊乱导致的肠源性尿毒素蓄积及肠道屏障损坏是促进CRF进展及其并发症发生的重要因素[4]。因此,“从肠治肾”有望成为CRF治疗的新途径。
中药治疗CRF疗效明确[5],其中大黄-丹参药对为临床治疗CRF的高频药对[6];且相关研究发现,大黄、丹参及其有效成分对肠道屏障功能均具有保护作用[7-9]。基于“复方-药对-有效成分”的研究思路,本课题组初步证实了大黄-丹参药对具有保护CRF大鼠肾功能的作用,但具体机制不明。基于此,本研究采用5/6肾切除法复制CRF模型大鼠,从肠源性尿毒素、肠道屏障角度探讨大黄-丹参药对延缓CRF进展的相关作用机制,以期为中药基于肠道系统治疗CRF提供实验依据。
1 材料
1.1 主要仪器
本研究所用主要仪器有:单级微手术电凝器(武汉春光医疗美容仪器有限公司),7080型全自动生化仪(日本积水医疗科技有限公司),LC-30A型超高效液相色谱仪、LCMS-8040型三重四极杆质谱仪联用系统(日本岛津公司),EG1150H型自动生物组织包埋机、UC7型超薄切片机、RM2255型切片机(德国Leica仪器有限公司),Ci-L型显微镜、Ni-U型荧光显微镜(日本Nikon公司),ME203E型电子分析天平(上海梅特勒-托利多仪器有限公司),ST16R型高速冷冻离心机(美国Thermo Fisher Scientific公司),GET96-PLUS型基因扩增仪(杭州柏恒科技有限公司),ABI7500型实时荧光聚合酶链式反应(RT-PCR)仪(美国ABI公司),HT7700型透射电子显微镜(日本HITACHI公司)。
1.2 主要药品与试剂
本研究所用主要药品与试剂有:大黄、丹参饮片[天津市中药饮片厂有限公司,批号分别为G1707045-01、G1706160-01;将两种饮片按1 ∶ 1质量比配伍,水煎煮2次后浓缩制成每毫升约含1.1 g(生药)的浓缩液],尿毒清颗粒(康臣药业有限责任公司,批号20181168,规格5 g/袋),注射用青霉素钠[哈药集团制药总厂,批号18020402-2,规格0.48 g(按C16H17N2NaO4S计);使用时每瓶用5 mL生理盐水溶解],戊巴比妥钠(北京化学试剂公司,批号020919),明胶海绵(江西众强实业有限公司,批号20190328),苏木素染色液、伊红染色液、Masson染色液(北京索莱宝科技有限公司,批号分别为G1140、G1100、G1343),氧化三甲胺(TMAO)、对甲基苯基硫酸钾、吲哚酚硫酸酯钾盐(上海甄准生物科技有限公司,批号1184-78-7、91978-69-7、2642-37-7,纯度均大于98.0%),小鼠抗大鼠闭合蛋白(Occludin)单克隆抗体(美国Invitrogen公司,批号33-1500),兔抗大鼠紧密连接蛋白1(ZO-1)多克隆抗体(美国Thermo Fisher Scientific公司,批号61-7300),Alexa Fluor? 555标记的羊抗小鼠免疫球蛋白G(IgG)二抗、Alexa Fluor? 488标记的羊抗兔IgG二抗(美国CST公司,批号分别为4409、4412),二脒基苯基吲哚(DAPI)、防荧光淬灭封片液[爱必信(上海)生物科技有限公司,批号分别为abs47047616、abs9234],Trizol试剂、RNA逆转录试剂盒、RT-PCR试剂盒(北京康为世纪生物科技有限公司,批号分别为CW0508S、CW2569M、CW2601M),乙腈、甲酸(色谱纯),去离子水,PCR引物(由生工生物工程股份有限公司合成,引物序列及产物长度信息见表1);其余试剂为实验室常用规格。
1.3 动物
本研究所用大鼠为SPF级雄性Wistar大鼠,体质量为180~200 g,购自北京维通利华实验动物技术有限公司,动物生产合格证号为SCXK(京)2016-0006。动物饲养于天津市医药科学研究所动物房,动物使用许可证号为SYXK(津)2016-0007。所有操作均严格按照天津市医药科学研究所实验动物伦理相关规定进行,并经过伦理委员会批准(批准文号IMPS-EAEP-Z-2018B1008-02)。
2 方法
2.1 分组、造模与给药
55只大鼠适应性喂养7天后,随机取10只大鼠作为假手术组(分离肾组织,但并不切除),剩余大鼠采用5/6肾切除法[10]复制CRF模型大鼠。具体操作如下:大鼠先行右侧2/3肾切除手术——术前2 h肌内注射青霉素钠(0.3 mL/只)预防感染,再腹腔注射戊巴比妥钠(45 mg/kg)麻醉后,剃去右侧肾区的毛发,并用碘伏-75%酒精消毒,以手术刀切开皮肤,找出右肾,剥离肾膜;以止血钳夹住右肾的肾蒂,剪去右肾的上1/3和下1/3,以电凝器将切面有效止血,再用明胶海绵吸附止血后,将肾平稳放回腹腔,逐层缝合。1周后大鼠再行左肾全切术——用3-0手术线结扎左肾肾蒂,切去左肾。各组大鼠于第2次术后1周,进行眼眶取血,并测定血清中肌酐(Scr)、尿素氮(BUN)含量,当两者水平较假手术组均升高时,表明大鼠造模成功(本研究共剔除死亡和不成模大鼠5只)。将造模成功的大鼠随机分为模型组、尿毒清颗粒组(2.5 g/kg,剂量根据临床等效剂量换算而得)和大黄-丹参药对高、低剂量组[6、3 g/kg(以生药量计),剂量根据临床等效剂量的12、6倍换算而得],每组10只。假手术组和模型组大鼠灌胃等体积水,给药组大鼠灌胃相应药物(以水作为溶剂,灌胃体积为10 mL/kg),每天1次,連续12周。
2.2 标本采集
末次给药后,收集各组大鼠24 h尿液,以检测尿肌酐(Ucr)含量。大鼠腹腔注射戊巴比妥钠(45 mg/kg)麻醉后,于腹主动脉取血。血样静置1~2 h后,以3 000 r/min离心10 min,分离上层血清于-20 ℃冻存,以检测相关生化指标。取血完成后,剖取各组大鼠肾组织,以4%多聚甲醛固定,用于苏木素-伊红(HE)染色和Masson染色;剖取回肠,部分用4%多聚甲醛固定,用于免疫荧光检测,其余部分于-80 ℃冻存,用于RT-PCR检测;剖取结肠,用2.5%戊二醛固定,用于透射电镜观察。
2.3 大鼠血清和尿液中肾功能指标的检测
取“2.2”项下采集的尿液和血清样本,按照相关试剂盒说明书进行操作,采用全自动生化分析仪检测血清中Scr、BUN含量和尿液中Ucr含量,并计算肌酐清除率[Ccr,Ccr=(Ucr×24 h尿量)/(Scr×1 440)]。
2.4 大鼠血清中肠源性尿毒素含量的检测
取“2.2”项下采集的血清样本,采用超高效液相色谱-电喷雾串联三重四极杆质谱(UHPLC-ESI-MS/MS)法同时测定大鼠血清中TMAO、硫酸吲哚酚(IS)、硫酸对甲酚(PCS)的含量。色谱条件采用色谱柱为InertSustain C18(100 mm×3.0 mm,3.0 ?m);柱温为35 ℃;流动相为乙腈-0.1%甲酸水溶液(25 ∶ 75,V/V);流速为0.4 mL/min;进样量为10 ?L。质谱条件采用离子源为ESI,正负离子模式;定量分析采用多重反应离子监测(MRM);加热模块温度为400 ℃;DL温度为250 ℃;雾化气流速为3.0 L/min;干燥气流速为15 L/min;离子源电压为4.0 kV。TMAO、IS、PCS质谱分析条件见表2。
2.5 大鼠回肠组织中Occludin、ZO-1 mRNA表达水平的检测
采用RT-PCR进行检测。按相关试剂(盒)说明书操作,将“2.2”项下冻存的各组大鼠回肠组织用Trizol試剂提取总RNA,并测定RNA浓度,然后将其稀释为250 mg/L,进行逆转录,获得cDNA。取cDNA 1 μL进行PCR扩增。PCR反应体系(20 μL)包括:2×UltraSYBR Mixture 10 μL,上下游引物各0.8 μL,cDNA 1.6 μL,ddH2O 6.8 μL。反应条件为:95 ℃预变性10 min;95 ℃ 变性15 s,60 ℃ 退火1 min,40个循环。溶解条件为:95 ℃ 15 s,60 ℃ 1 min,95 ℃ 15 s,60 ℃ 15 s。以GADPH作为内参,采用2-ΔΔCt法计算Occludin、ZO-1的表达水平。实验重复4次。
2.6 大鼠回肠组织中Occludin、ZO-1蛋白表达水平检测
采用免疫荧光法进行检测。将“2.2”项下4%多聚甲醛固定好的回肠组织脱水,石蜡包埋后切片(4 μm),用二甲苯和100%、95%、85%、75%的乙醇溶液对切片进行脱蜡,再以微波炉加热进行抗原修复,冷却至室温后,以磷酸盐缓冲液(PBS)洗涤3次;以5% BSA封闭40 min,向切片表面均匀滴加Occludin、ZO-1一抗(稀释度分别为1 ∶ 100、1 ∶ 50),于4 ℃冰箱孵育过夜;以PBS洗涤3次后,向切片表面均匀滴加荧光二抗(稀释度为1 ∶ 500),室温避光孵育2 h;以PBS洗涤3次,滴加DAPI染色液复染细胞核,于室温避光孵育10 min;以PBS洗涤3次,向切片滴加防荧光淬灭封片液封片,然后置于荧光显微镜下观察并拍照。采用Imaging 5.10.00软件分析红色和绿色区域的荧光强度(红色荧光表示Occludin蛋白的阳性染色,绿色荧光表示ZO-1蛋白的阳性染色),用荧光强度来表示目标蛋白的表达水平。实验重复4次。
2.7 大鼠肾组织的病理学形态观察和结肠组织的超微结构观察
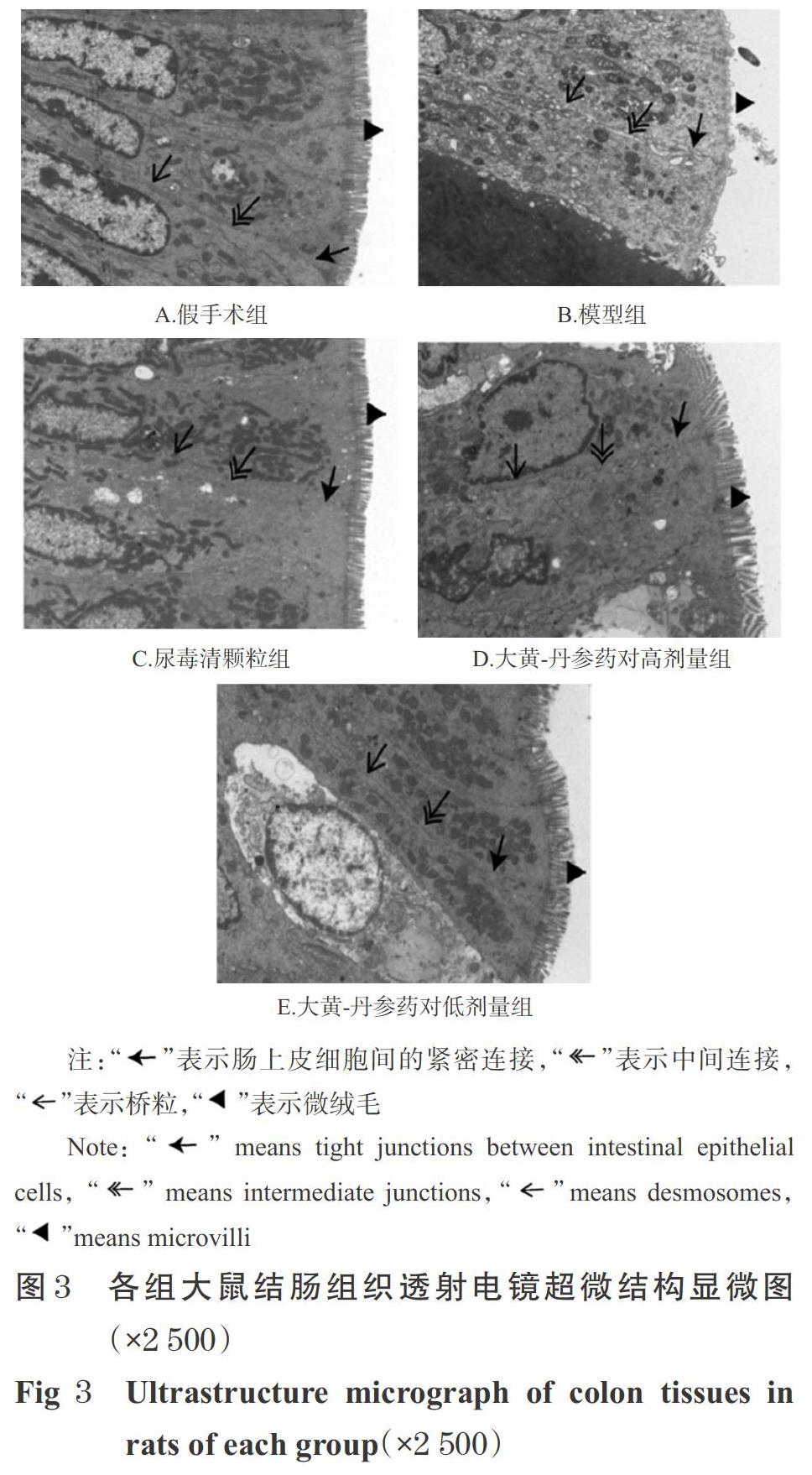
将“2.2”项下4%多聚甲醛固定好的肾组织脱水,石蜡包埋后切片(4 μm),进行HE和Masson染色,然后于显微镜下观察肾组织病理学形态变化并拍照。将“2.2”项下2.5%戊二醛固定好的结肠组织取出,于PBS中浸洗3次,以1%锇酸室温固定2 h,再以50%~100%的乙醇溶液和丙酮逐级脱水,然后浸透、包埋后,切片(60~80 nm),行乙酸双氧铀和酸铅双重染色,于透射电镜下观察并拍照。
2.8 统计学分析
采用SPSS 19.0软件进行数据统计分析,计量资料以x±s表示,组间比较采用单因素方差分析。P<0.05表示差异有统计学意义。
3 结果
3.1 大黄-丹参药对对CRF模型大鼠血清和尿液中肾功能指标的影响
与假手术组比较,模型组大鼠血清中Scr、BUN含量均显著升高,尿液中Ucr含量和Ccr均显著降低(P<0.01);与模型组比较,尿毒清颗粒组和大黄-丹参药对高、低剂量组大鼠血清中Scr、BUN含量均显著降低,尿液中Ucr含量显著升高(P<0.05或P<0.01),详见表3。
3.2 大黄-丹参药对对CRF模型大鼠肠源性尿毒素含量的影响
与假手术组比较,模型组大鼠血清中TMAO、PCS、IS含量均显著升高(P<0.01);与模型组比较,尿毒清颗粒组和大黄-丹参药对高、低剂量组大鼠血清中TMAO、PCS、IS含量均显著降低(P<0.05或P<0.01),详见表4。
3.3 大黄-丹参药对对CRF模型大鼠回肠组织中Occludin、ZO-1 mRNA表达的影响
与假手术组比较,模型组大鼠回肠组织中Occludin、ZO-1 mRNA表达水平均显著降低(P<0.01);与模型组比较,尿毒清颗粒组和大黄-丹参药对高剂量组大鼠回肠组织中Occludin、ZO-1 mRNA以及大黄-丹参药对低剂量组的Occludin mRNA表达水平均显著升高(P<0.05或P<0.01),详见表5。
3.4 大黄-丹参药对对CRF模型大鼠回肠组织中Occludin和ZO-1蛋白表达的影响
与假手术组比较,模型组大鼠回肠组织中Occludin、ZO-1蛋白表达水平均显著降低(P<0.01);与模型组比较,尿毒清颗粒组和大黄-丹参药对高、低剂量组大鼠回肠组织中Occludin、ZO-1蛋白表达水平均显著升高(P<0.01),详见图1、表6。
3.5 大黄-丹参药对对CRF模型大鼠肾组织病理学形态的影响
HE和Masson染色结果均显示:假手术组大鼠肾小球正常,肾小管上皮完整,未见变性、坏死及管型,肾间质未见炎症细胞浸润和纤维化;模型组大鼠部分肾小球硬化,肾小管扩张,肾间质可见炎症细胞浸润和纤维化;与模型组比较,尿毒清颗粒组和大黄-丹参药对高、低剂量组大鼠肾间质炎症细胞浸润和纤维化均有不同程度减轻,详见图2。
3.6 大黄-丹参药对对CRF模型大鼠结肠组织超微结构的影响
假手术组大鼠肠黏膜上皮细胞轻微水肿,细胞膜完整;胞质内细胞器数量丰富、结构完整;微绒毛排列整齐、长短均一,未见明显萎缩、脱落;上皮细胞间紧密连接、中间连接数量较多,桥粒丰富,细胞间隙狭窄;肠上皮屏障结构完整。模型组大鼠肠上皮细胞重度水肿,上皮细胞大面积脱落、游离,细胞膜局部破损;胞质内细胞器数量丰富,细胞器肿胀;微绒毛排列稀疏、大面积脱落;上皮细胞间紧密连接、中间连接数量减少,桥粒致密区较小,可见少量半桥粒,细胞间隙明显增宽,肠上皮结构屏障重度损伤。尿毒清颗粒组和大黄-丹参药对高、低剂量组大鼠肠黏膜上皮细胞中度水肿,细胞膜完整;胞质内细胞器数量丰富,明显肿胀;微绒毛排列整齐、长短均一,局部略微稀疏;上皮细胞间紧密连接、中间连接数量较多,桥粒丰富,细胞间隙小区域增宽;肠上皮屏障结构损伤程度较模型组减轻,详见图3。
4 讨论
CRF属中医学“溺毒”“水肿”“肾劳”“关格”等范畴,脾肾衰败、水毒湿浊潴留是引起CRF的关键病因,因此治疗CRF应从通腑泄浊、活血化瘀方面进行[11]。大黄为通腑泄浊代表药,有推陈致新、清泄浊毒的功效;丹参为活血化瘀类药物,有祛瘀生新、通行血脉之效[12]。基于此,本文研究大黄-丹参药对对CRF模型大鼠肠源性尿毒素和肠道屏障功能的影响,以探讨其对CRF缓解作用的机制。尿毒清颗粒是临床治疗CRF的常用药物,在我国使用超过10年,疗效显著,具有通腑泄浊、健脾利湿、活血化瘀等功效[13],与大黄-丹参药对的泄浊化瘀治法[6]类似,因此本研究选择尿毒清颗粒作为阳性对照药。本研究结果发现,大黄-丹参药对能够显著降低CRF模型大鼠血清中BUN、Scr含量,升高尿液中Ucr含量及Ccr,提示该药对能够通过促进Scr的排泄来发挥保护CRF大鼠肾功能的作用。
在CRF进展过程中,肠道系统会发生病变;而从修复肠道屏障和调节肠道代谢物等角度治疗CRF中的肠道病变,对延缓CRF进程、减缓肾损伤及降低心血管并发症风险等具有效果[4,14]。肠源性尿毒素是来源于食物且由肠道菌群酵解产生的一类肠道代谢物;膳食-肠道微生物-肝共同组成了肠源性尿毒素的生物合成途径[15]。新生成的游离肠源性尿毒素如PCS和IS会与血液中的白蛋白可逆性地非共价结合,再循环到肾,通过肾小管上皮细胞主动分泌和转运机制排出体外[16]。CRF患者的肠道环境因饮食变化和血液循环中尿毒素的流入而改变,促进了肠源性尿毒素的生成;又因CRF患者肾功能受损、排出途径受阻,导致肠源性尿毒素的体内蓄积[17]。相关研究表明,蓄积的肠源性尿毒素可通过诱导氧化应激、激活炎症反应等机制促进肾细胞发生上皮-间充质转化,加速肾纤维化进程[15]。因此,降低肠源性尿毒素含量能有效延缓CRF进展。本研究以尿毒素TMAO、PCS和IS为指标,探讨了大黄-丹参药对清除肠源性尿毒素的作用,结果发现,该药对能有效降低血清中肠源性尿毒素的含量,提示其能促进肠源性尿毒素的排泄,从而更好地保护CRF模型大鼠残存的肾功能。
肠上皮屏障由一层连续的上皮细胞和将上皮细胞间隙密封起来的顶端连接复合体组成,是肠道屏障的主要决定因素,对维持肠道内微生态、阻止病原微生物侵入至关重要[4]。相关研究发现,尿毒素水平的升高和脲酶菌群的增殖会增加肠道内氨的产生,过量的氨转化为氢氧化铵,可引起肠道pH值的改变和肠上皮细胞间紧密連接蛋白的破坏[18]。肠屏障功能受损、肠道通透性增加、内毒素入血引发炎症反应,会加重肾损伤[19]。本研究结果显示,模型组大鼠回肠组织中Occludin、ZO-1 mRNA及蛋白的表达水平均显著降低(P<0.05或P<0.01);肾组织肾小球硬化,肾小管扩张,肾间质可见炎症细胞浸润和纤维化;结肠上皮屏障结构重度损伤,表明CRF模型大鼠的肾组织和肠道屏障功能受损。经大黄-丹参药对干预后,大鼠回肠组织中Occludin、ZO-1 mRNA及蛋白的表达水平均显著升高(低剂量组的ZO-1 mRNA除外,P<0.05或P<0.01);肾间质炎症细胞浸润、纤维化程度和结肠上皮屏障结构损伤程度均减轻,表明该药对可减轻CRF模型大鼠的肠道屏障功能损伤。
综上所述,大黄-丹参药对能有效保护CRF模型大鼠残存的肾功能;其作用机制可能与降低大鼠血清中肠源性尿毒素含量,上调回肠组织中Occludin、ZO-1的mRNA及蛋白表达水平从而改善肠道屏障功能有关。
参考文献
[ 1 ] 孙响波,李永伟,邓润钧,等.黑地黄丸对慢性肾衰竭研究的新进展[J].中国实验方剂学杂志,2019,25(24):219- 225.
[ 2 ] GBD Chronic Kidney Disease Collaboration. Global,regional,and national burden of chronic kidney disease,1990-2017:a systematic analysis for the Global Burden of Disease Study 2017[J]. Lancet,2020,395(10225):709- 733.
[ 3 ] MEIJERS B K,EVENEPOEL P. The gut-kidney axis:indoxyl sulfate,p-cresyl sulfate and CKD progression[J]. Nephrol Dial Transplant,2011,26(3):759-761.
[ 4 ] MEIJERS B,FARR? R,DEJONGH S,et al. Intestinal barrier function in chronic kidney disease [J].Toxins(Basel),2018,10(7):298.
[ 5 ] 张洋,黄学宽,沈清,等.复肾功方对慢性肾衰竭大鼠Wnt/ β-catenin 信号途径的影响[J].中国实验方剂学杂志,2020,26(24):89-95.
[ 6 ] 杨佳.基于数据挖掘的近20年慢性肾衰中药用药规律研究[D].银川:宁夏医科大学,2019.
[ 7 ] 李兆霞,许才明,罗亚岚,等.大黄对重症急性胰腺炎肠道屏障保护的研究进展[J].中国中医急症,2020,29(4):732-734、752.
[ 8 ] 李艳君,郭瑞敏,孙燕妮.大黄素改善脓毒症肠机械屏障损伤的研究进展[J].中国中医急症,2019,28(3):542- 545.
[ 9 ] 廖吕钊,江荣林.丹参酮改善脓毒症肠屏障功能的研究进展[J].浙江中医药大学学报,2017,41(2):171-174.
[10] JI C,DENG Y,YANG A,et al. Rhubarb enema improved colon mucosal barrier injury in 5/6 nephrectomy rats may associate with gut microbiota modification[J]. Front Pharmacol,2020,11:1092.
[11] 王河宝,胡芳,喻松仁.慢性肾衰中医辨证分型研究概况[J].江西中医药,2020,51(1):72-74.
[12] 申屠伟丰,何永春.大黄丹参汤联合左卡尼汀治疗急性肾功能衰竭对血肌酐、尿素氮水平影响[J].新中医,2016,48(4):70-72.
[13] 刘胜阳.尿毒清颗粒用于慢性肾功能衰竭患者治疗中的临床效果[J].中国现代药物应用,2016,10(22):104-105.
[14] 王会玲.肠源性尿毒素毒症与慢性肾衰竭进展及干预策略[J].中国中西医结合肾病杂志,2020,21(1):79-81.
[15] LIU Y,DAI M. Trimethylamine N-oxide generated by the gut microbiota is associated with vascular inflammation:new insights into atherosclerosis[J/OL]. Mediators Inflamm,2020[2020-11-14].http://pubmed.ncbi.nlm.nih.gov/ 321484381.DOI:10.11551202014634172.
[16] EDAMATSU T,FUJIEDA A,ITOH Y. Phenyl sulfate,indoxyl sulfate and p-cresyl sulfate decrease glutathione level to render cells vulnerable to oxidative stress in renal tubular cells[J]. PLoS One,2018,13(2):e193342.
[17] 李倩玉,周江慧,李娜,等.腸源性尿毒症毒素在肾脏病领域的研究进展[J].中国实验诊断学,2019,23(3):561- 563.
[18] VAZIRI N D,YUAN J,NORRIS K. Role of urea in intestinal barrier dysfunction and disruption of epithelial tight junction in chronic kidney disease[J]. Am J Nephrol,2013,37(1):1-6.
[19] HUANG W,ZHOU L,GUO H,et al. The role of short- chain fatty acids in kidney injury induced by gut-derived inflammatory response[J]. Metabolism,2017,68:20-30.
(收稿日期:2020-12-14 修回日期:2021-01-05)
(编辑:唐晓莲)
猜你喜欢 慢性肾衰竭丹参 本草园——丹参家庭医药(2021年1期)2021-02-04责任制护理干预对慢性肾衰竭维持性血液透析患者生活质量及护理满意度影响评价健康大视野(2019年6期)2019-04-25心理干预对慢性肾衰竭患者抑郁症状的影响研究健康大视野(2018年17期)2018-12-28慢性肾衰竭患者血液透析治疗中应用舒适护理的可行性中文信息(2018年2期)2018-05-30防治冠心病首选丹参农村百事通(2018年3期)2018-03-14升阳益胃汤用于慢性肾衰竭脾虚湿盛型水肿临床治疗中的疗效探析中西医结合心血管病电子杂志(2017年26期)2018-02-06高通量血液透析治疗老年慢性肾衰竭的效果分析中西医结合心血管病电子杂志(2016年32期)2017-06-19一味丹参,功同四物家庭医药·快乐养生(2017年6期)2017-06-16尿毒清颗粒剂治疗慢性肾衰竭68例临床疗效观察中国民族民间医药·下半月(2014年1期)2015-02-02丹参酚酸B对外周血内皮祖细胞增殖、粘附和迁移功能的影响中国民族民间医药·上半月(2013年1期)2013-11-01



