刘惠娜 李艳玲 曹旺 邓常清

〔摘要〕 目的 以凝血因子Ⅻ (coagulation factor Ⅻ, FⅫ)為靶点探讨药根碱抗血栓作用的机制。方法 通过Ledock软件将药根碱分子与内源性凝血途径接触激活阶段关键靶蛋白FⅫ、活化凝血因子FⅫ (actived coagulation factor Ⅻ, FⅫa)、凝血因子Ⅺ (coagulation factor Ⅺ, FⅪ)和活化凝血因子Ⅺ (actived coagulation factor Ⅺ, FⅪa)进行分子对接,以结合能低于-5 kcal/mol作为阈值判断药根碱与接触激活因子的结合活性;采用体外凝血实验法检测血浆活化部分凝血活酶时间(activated partial thromboplastin time, APTT)、血浆凝血酶原时间(plasma prothrombin time, PT)、凝血酶时间(plasma prothrombin time, TT);乏因子血浆纠正试验检测FⅫ、FⅪ、凝血因子Ⅸ (coagulation factor Ⅸ, FⅨ)、凝血因子Ⅷ (coagulation factor Ⅷ, FⅧ)、凝血因子Ⅹ (coagulation factor Ⅹ, FⅩ)和凝血因子Ⅶ (coagulation factor Ⅶ, FⅦ)的活性的抑制作用;Western blot法检测药根碱对FⅫ蛋白激活的抑制作用。结果 (1)分子对接实验表明,药根碱与FⅫa、FⅪa结合能均低于-5 kcal/mol,结合活性良好。(2)体外实验中,0.2~0.8 mg/mL药根碱均可显著延长APTT (P<0.01),但不延长PT和TT (P>0.05)。(3)药根碱各剂量均显著降低FⅫ活性(P<0.01),药根碱高剂量(0.8 mg/mL)可降低FⅪ活性(P<0.05),但对FⅨ、FⅧ、FⅩ及FⅦ活性无显著影响(P>0.05)。(4)药根碱各剂量均显著抑制FⅫ蛋白的激活(P<0.01)。结论 药根碱与FⅫa对接较好,显著延长APTT,抑制FⅫ蛋白激活,降低血浆FⅫ活性,提示其抗栓作用可能通过抑制FⅫ的活性而发挥。
〔关键词〕 药根碱;内源性凝血途径;凝血因子Ⅻ;分子对接
〔中图分类号〕R285.5 〔文献标志码〕A 〔文章编号〕doi:10.3969/j.issn.1674-070X.2021.01.006
〔Abstract〕 Objective To investigate the anticoagulant mechanism of jatrorrhizine with coagulation factor Ⅻ(FⅫ) as the target. Methods Factor Ⅻ (FⅫ), actived coagulation factor Ⅻ (FⅫa), coagulation factor Ⅺ (FⅪ) and actived coagulation factor Ⅺ (FXIa), which are the key target proteins in the contact activation stage of endogenous coagulation pathway, were performed molecular docking with jatrorrhizine by the Ledock software, the binding activity between jatrorrhizine and contact activation factors was determined by the threshold that binding energy lower than -5 kcal/mol; the activated partial thromboplastin time (APTT), prothrombin time (PT) and thrombin time (TT) were detected by vitro coagulation test; the inhibitory effect of jatrorrhizine on the activities of FⅫ, FⅪ, coagulation factors Ⅸ (FⅨ), coagulation factors Ⅷ (FⅧ), coagulation factors Ⅹ (FⅩ) and coagulation factors Ⅶ (FⅦ) was detected by factor deficient plasma correction test; Western blot was used to detect the inhibitory effect of jatrorrhizine on activation of FⅫ protein. Results (1) The molecular docking experiments showed that the binding energies of jatrorrhizine with FⅫa and FXIa were lower than -5 kcal/mol, which indicated high binding activity. (2) Jatrorrhizine prolonged APTT at 0.2-0.8 mg/mL (P<0.01), but did not prolong PT and TT (P>0.05) in vitro experiment. (3) Various concentration of jatrorrhizine significantly decreased the activity of FⅫ (P<0.01), high concentration of jatrorrhizine (0.8 mg/mL) decreased the activity of FⅪ (P<0.05), but had no significant effect on the activities of FⅨ, FⅧ, FⅩ and FⅦ (P>0.05). (4) Various concentration of jatrorrhizine significantly inhibited the activity of FⅫ protein(P<0.01). Conclusion Jatrorrhizine has a good docking with FⅫa. It can significantly prolong APTT, inhibit activation of FⅫ protein and reduce the activity of plasma FⅫ. All suggested that antithrombotic effect of jatrorrhizine may be exerted by inhibiting the activity of FⅫ.
〔Keywords〕 jatrorrhizine; endogenous coagulation pathway; coagulation factor Ⅻ; molecular docking
血栓形成是严重威胁人类健康的一种病理过程。以血栓形成为基本病理特征的心脑血管疾病如中风、心肌梗死等,起病急、病情重、死亡率高,占非传染性疾病总死亡率的44%,已成为我国人口死亡与致残的首位原因[1]。目前,应用的抗血栓药可分为抗血小板药、抗凝血药和溶血栓药三大类[2]。随着人们对血栓形成机制的不断深入了解,以直接抑制凝血酶或抑制凝血因子Xa为作用靶点的抗栓药物也逐渐普及,但这些药物均干扰生理性止血过程,存在较严重的出血不良反应[3]。近年来研究发现,抑制内源性凝血途径的接触激活因子凝血因子Ⅻ (coagulation factor Ⅻ, FⅫ)、凝血因子Ⅺ (coagulation factor Ⅺ, FⅪ)、前激肽释放酶(prekallikrein, PK)或高分子激肽原(high molecular weight kininogen, HK)具有显著的抗血栓效果却无明显的出血不良反应[4-6],提示内源性凝血途径的接触激活因子有望成为抗血栓药物的重要靶点。许多中草药和复方特别是活血化瘀类中药均能有效地防治血栓性疾病,主要是从抗血小板、抗凝血酶和促纤溶等方面发挥作用,确有疗效且安全的以接触激活因子为靶点的抗栓药物还不多。
药根碱(jatrorrhizine)是从毛茛科植物黄连、小檗科植物功劳木及防己科植物青牛胆等植物中提取出来的异喹啉类生物碱,其结构与小檗碱类似。药根碱及其衍生物具有抑制炎症、降血糖、降血脂、抗风湿、抗肿瘤等药理作用[7-9],但其抗血栓作用的研究尚未涉及。本课题组以往研究发现,药根碱静脉注射可延长颈动脉血栓模型血管闭塞时间,减轻动脉血栓和静脉血栓模型的血栓重量,但不显著延长小鼠尾出血时间,提示药根碱具有确切的抗动脉血栓和静脉血栓形成的作用,出血不良反应轻,其作用机制可能是通过抑制凝血因子特别是内源性凝血途径的凝血因子活性而发挥作用[10]。为进一步研究药根碱抗血栓作用的机制,本研究从凝血因子活性探讨药根碱对凝血因子的抑制作用,明确其可能的作用靶点,为进一步揭示其作用机制提供科学依据。
1 材料和方法
1.1 试验药物
药根碱(jatrorrhizine,CAS 3621-38-3,批号PRF908
0441),质量分数≥95%,购自成都普法瑞科技开发有限公司。低分子肝素钠(达肝素,dalteparin sodium, CAS
9041-08-1,批号MB1914)购自大连美仑生物公司,每克抗因子Xa活性效价为133 000 U,使用时用生理盐水配制。玉米胰蛋白酶抑制剂(corn trypsin inhibitor,CTI,批号1018)购自美国Molecular Innovations公司。
1.2 动物
新西兰大白兔,雄性,体质量1.6~2.0 kg,动物许可证号:SCXK(湘)2015-0004,购自湖南太平生物科技有限公司。动物实验在湖南中医药大学实验动物中心完成,实验场地许可证号:SYXK(湘)2013-0005。动物的使用符合科技部《关于善待实验动物的指导性意见》相关规定。
1.3 主要试剂和仪器
高岭土(kaolin,批号93-1348),购自美国Strem Chemicals公司。血浆活化部分凝血活酶时间(activated partial thromboplastin time, APTT,批号253259)试剂、凝血酶原时间(prothrombin time, PT,批号253305)试剂、凝血酶时间(thrombin time, TT,批号252465)试剂、纤维蛋白原(fibrinogen, FIB,批号252569)试剂及质控品(批号12351,253868)、定标品(批号253180)、乏因子Ⅻ血浆(deficient Ⅻ plasma, 批号250883)、乏因子Ⅺ血浆(deficient Ⅺ plasma, 批号252200)、乏因子Ⅸ血浆(deficient Ⅸ plasma, 批号253639)、乏因子Ⅹ血浆(deficient Ⅹ plasma, 批号251434)、乏因子Ⅶ血浆 (deficient Ⅶ plasma, 批號252767)均购自法国斯塔高公司。乏因子Ⅷ血浆(deficient Ⅷ plasma, 批号547676)购自希森美康医用电子有限公司。FⅫ蛋白(factor Ⅻ protein,批号7690-250)购自美国Biovision公司。FⅫ抗体(anti-factor Ⅻ,批号ab242123)购自Abcam公司。HRP标记的羊抗兔二抗,批号AT0097,购自美国CMCTAG公司。TBST缓冲液(批号MA0091)、WB脱脂牛奶封闭液(批号MA0097)、飞克特超敏ECL液(批号MA0186)均购自大连美仑生物公司。
STA Compact Max 全自动凝血分析仪(法国斯塔高公司); CS-5100全自动凝血分析仪(希森美康医用电子有限公司)。
1.4 方法
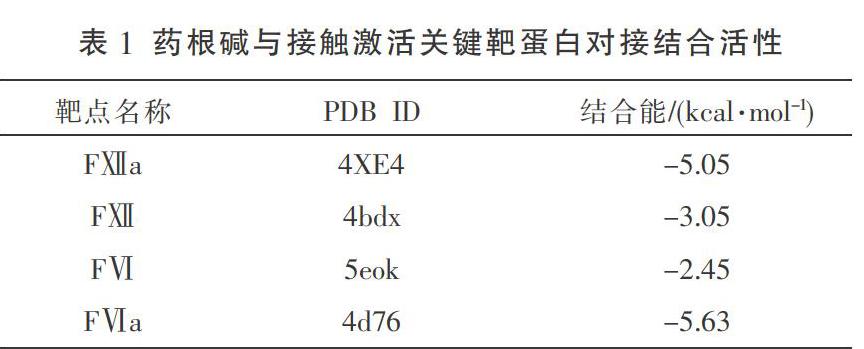
1.4.1 分子对接法评估药根碱与接触激活因子FⅫ、FⅪ的结合活性 从蛋白质数据库(protein data bank, PDB)中下载相应靶标蛋白的PDB文件:FⅫ对应的PDB_ID为4bdx,FⅫa对应的PDB_ID为4xe4,FⅪ对应的PDB_ID为5eok,FXIa对应的PDB_ID为4d76。选择靶标蛋白上的配体分子再通过pymol的GetBox Plugin计算对接盒子,再使用该对接盒子通过Ledock软件进行靶标受体蛋白去配体、离子、水等预处理后,导入FⅫ、FⅫa、FⅪ和FⅪa,并分别通过Ledock软件与药根碱分子进行对接,对接结果通过pymol进行可视化。评估药根碱分子和靶标蛋白的结合活性,以结合能低于-5 kcal/mol作为阈值[11],结合能越低,则表明结合活性越好。
1.4.2 凝固法检测药根碱在体外对APTT、PT、TT、FIB的影响 新西兰兔7只,采血前12 h禁食不禁水。将家兔仰卧固定,在左侧胸部心脏部位去毛、消毒,于第3肋间胸骨左缘3 mm心尖处将注射针垂直刺入心脏采血,然后与3.8%枸橼酸钠混匀抗凝,3 000 r/min 4 ℃离心10 min,取上清液即兔贫血小板血浆(platelet poor plasma, PPP),分装后-80 ℃保存备用。
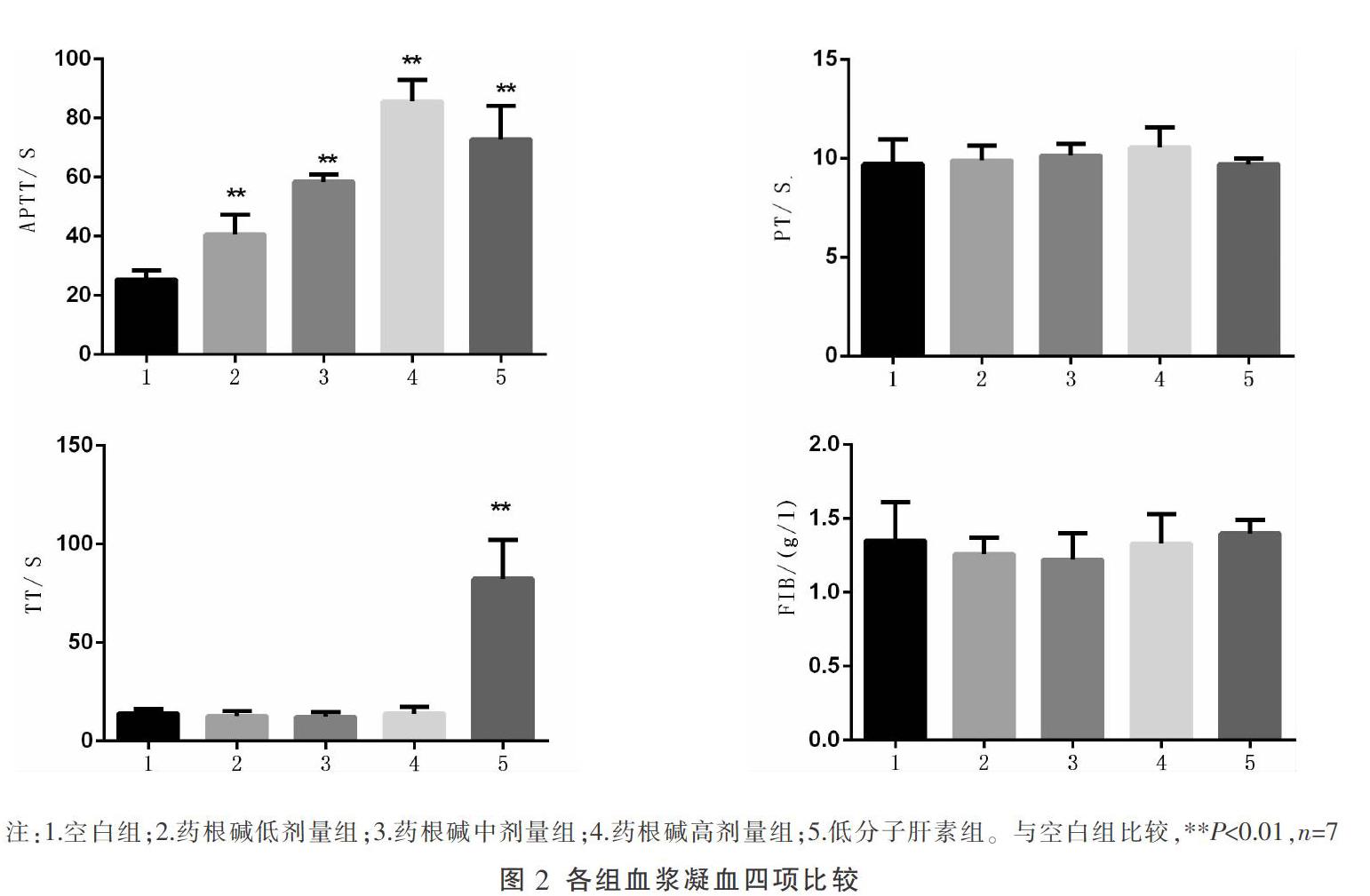
将超纯水、不同浓度药根碱、低分子肝素分别加入同一家兔PPP,编组为空白组、药根碱低剂量组(0.2 mg/mL)、药根碱中剂量组(0.4 mg/mL)、药根碱高剂量组(0.8 mg/mL)和肝素组(3.125 IU/mL),采用全自动凝血分析仪测定APTT、PT、TT和FIB。
1.4.3 乏因子血浆纠正试验检测药根碱在体外对凝血因子活性的抑制效应 为了检验药根碱对凝血途径影响的具体作用因子,采用乏因子血浆纠正试验测定凝血因子活性,其活性是通过待测血浆纠正乏因子血浆的能力而测得。分组同“1.4.2”,将待测血浆分别与凝血因子活性测定试剂盒(即缺乏FⅫ、FⅪ、FⅨ、FⅧ、FⅩ、FⅦ的血浆)混合,然后应用全自动血凝仪测定血浆FⅫ、FⅪ、FⅨ、FⅧ、FⅩ、FⅦ活性。
进一步检验药根碱与FⅫ抑制剂是否具有相似效应,将超纯水、不同浓度药根碱、CTI(FⅫ抑制剂)分别加入同一家兔PPP,编组为空白组、药根碱低剂量组(0.2 mg/mL)、药根碱中剂量组(0.4 mg/mL)、药根碱高剂量组(0.8 mg/mL)和抑制剂组(0.025 mg/mL)。然后采用乏因子血浆纠正试验测定凝血因子Ⅻ活性。
1.4.4 Western blot法检测药根碱在体外对FⅫ蛋白激活的抑制作用 将等容积超纯水、FⅫ抑制剂、药根碱(1.8 mg/mL)、药根碱(2.4 mg/mL)分别加入等容积同一浓度的FⅫ蛋白(0.25 mg/mL)中,编组为空白组、抑制剂组(0.25 mg/mL)、药根碱低剂量组、药根碱高剂量组,然后37 ℃孵育5 min后,加入FⅫ激活物高岭土(5 mg/mL),再37 ℃孵育5 min,10 000 r/min离心5 min,取上清,加入5×上样缓冲液,沸水煮10 min后,上样(每孔10 μL)、电泳2.5 h、转膜2 h、封闭2 h,然后FⅫ抗体4 ℃孵育过夜,TBST洗膜,孵二抗1.5 h后显影。用Image Pro-Plus
6.0分析软件计算各组累积光密度值(integrated optical density, IOD)。FⅫ蛋白在未激活状态下以80 kDa酶原形式存在,被激活后裂解。本实验在不同干预因素处理后,检测80 kDa FⅫ酶原含量来判断FⅫ的激活情况。80 kDa FⅫ蛋白IOD值越高,即FⅫ酶原含量越高,表明被激活的FⅫ蛋白越少。
1.5 统计学分析与方法
采用SPSS 20.0统计软件分析实验数据,各组数据计量资料以“x±s”表示,多组间比较采用单因素方差分析,组间两两比较方差齐者用LSD检验,方差不齐者用Dunnetts T3检验。P<0.05表示差异有统计学意义。
2 结果
2.1 藥根碱与接触激活因子FⅫ、FⅪ的结合活性 药根碱占据了FⅫa蛋白中由GLN-489、GLY-374、ARG-413、TYR-372等残基构成的活性空腔,其分子与FⅫa的GLN-489残基形成了2个氢键,与GLY-374残基形成1氢键,与TYR-372形成了2个π堆积,与ARG-413形成了1个π阳离子相互作用,且药根碱与FⅫa结合能低于-5 kcal/mol,具有强亲和力。药根碱占据了FⅪa蛋白中由LYS-192、ASP-189等残基构成的活性空腔,其分子与FⅪa的ASP-189残基形成了1个氢键,与LYS-192残基形成1个疏水键,且药根碱与FⅪa亲和能低于-5 kcal/mol,具有较强亲和力。分子对接结果表明,药根碱分子可与FⅫa、FⅪa结合,可能对FⅫa、FⅪa活性具有抑制作用。见表1、图1。
2.2 药根碱对兔血浆APTT、PT、TT、FIB的影响
与空白组比较,药根碱各剂量组均可显著延长APTT(P<0.01),但不延长PT、TT(P>0.05)。低分子肝素显著延长APTT、TT(P<0.01)。药根碱各剂量和低分子肝素对PT、FIB含量无显著影响(P>0.05)。见图2。
2.3 药根碱在体外对兔血浆凝血因子活性的影响
2.3.1 药根碱对兔血浆FⅫ、FⅪ、FⅨ、FⅧ、FⅩ及FⅦ活性的影响 与空白组比较,药根碱各剂量组均可显著降低FⅫ因子活性(P<0.01);药根碱高剂量组可降低FⅪ因子活性(P<0.05);但药根碱各剂量组对FⅨ、FⅧ、FⅩ及FⅦ因子活性无显著影响(P>0.05)。低分子肝素可显著降低FⅫ、FⅪ、FⅨ及FⅧ因子活性(P<0.01),但对FⅩ及FⅦ因子活性无显著影响(P>0.05)。见图3。
2.3.2 药根碱对兔血浆FⅫ活性的影响 与空白组比较,药根碱各剂量组可显著降低FⅫ因子活性(P<0.01),抑制剂组可显著降低FⅫ因子活性(P<0.01)。与抑制剂组比较,药根碱各剂量组FⅫ因子活性无显著差异(P>0.05),表明药根碱具有类似FⅫ抑制剂效应。见图4。
2.4 药根碱对FⅫ蛋白激活的影响
空白组FⅫ蛋白IOD为0,表明没有抑制剂作用,FⅫ全部被高岭土激活。与空白组比较,抑制剂组和药根碱组FⅫ蛋白IOD值均显著升高,差异有统计学意义(P<0.01)。说明药根碱和抑制剂都能抑制高岭土对FⅫ蛋白的激活。见图5。
3 讨论
以往研究发现通过基因剔除实验抑制内源性凝血途径的接触激活因子FⅫ、FⅪ可抑制闭塞性血栓形成。且抑制FⅫ无出血倾向,抑制FⅪ的出血倾向远远低于FⅧ和FⅨ缺陷,提示接触激活因子FⅫ、FⅪ参与促进血栓形成的病理过程,却不是生理止血所必需的[12-14]。在血栓形成过程中,以FⅫ为起点的内源性凝血途径的瀑布反应,产生大量凝血酶,进而产生大量纤维蛋白,使血栓增殖、稳固,从而产生闭塞性血栓。因此,以FⅫ为起点的内源性凝血途径的激活是血栓形成与稳定的关键。诸多实验亦证实,基因剔除FⅫ(FⅫ-/-)小鼠可以抑制FeCl3诱导的颈总动脉和肠系膜动脉血栓形成,而注射FⅫ后,血栓就快速形成[15-17]。在下腔静脉结扎血栓模型,FⅫ-/-同样可以抑制深静脉血栓形成[18]。由此,接触激活因子FⅫ有望成为抗栓药物的新靶点[19],并且以FⅫ为靶点的抗血栓研究已取得一定进展。Yau J W等[20]通过寡义反核苷酸技术ASO下调FⅫ表达,可显著抑制小鼠下腔静脉结扎的血栓形成和FeCl3诱导的肠系膜动脉血栓形成,且同时对尾出血时间并无显著影响。但通过ASO下调FⅫ需要的时间长,起效慢,且存在脱靶可能。来源于骚扰蝽中肠的重组FⅫa的竞争性抑制物rHA-infestin-4具有明显的抗栓效果[21],但rHA-infestin-4在高浓度时抑制FXa活性和纤溶酶[22]。可以口服的小分子 FⅫa抑制剂如3-甲酰胺香豆素适合长期抗栓应用,但都有待进一步研究[23]。
中医药防治心脑血管血栓性疾病疗效肯定,相比目前常用的抗血栓药,中草药可以从多途径、多靶点发挥抗血栓作用,且作用平和,不良反应少。但以往多是从保护血管内皮细胞(vascular endothelial cell, VEC)、增加VEC抗血栓形成,抑制血小板黏附、聚集、释放,增强抗凝、促进纤溶等方面进行研究[24-26],且对这些药物抗栓的作用机制研究还存在诸多不足。因此,进一步从天然产物中寻找以FⅫ为靶点的抗血栓药物具有重要的应用价值。
为进一步研究药根碱抗血栓作用机制,探讨其是否可以通过抑制内源性凝血途径的激活而发挥抗血栓的作用,寻找其抗栓作用的可能靶点,本研究将药根碱分子与接触激活关键靶蛋白FⅫ、FⅫa、FⅪ和FⅪa通过Ledock软件进行分子对接,结果显示药根碱与FⅫa、FⅪa活性中心对接良好,提示药根碱可能对FⅫa、FⅪa具有抑制作用。进而通过体外实验检测药根碱对家兔血浆APTT、PT、TT和FIB的影响,发现药根碱可显著延长APTT,但不延长PT和TT,而APTT是反映内源性凝血途径凝血活性的指标,提示药根碱可能通过与FⅫa、FXIa的活性中心结合而抑制内源性凝血途径的活性,从而延长APTT。我们进一步通过乏因子血浆纠正试验分析了药根碱对凝血过程中主要因子FⅫ、FⅪ、FⅨ、FⅧ、FⅩ和FⅦ活性的影响,结果显示不同浓度药根碱均显著降低FⅫ活性,其对FⅫ的抑制作用与CTI(FⅫ抑制剂)类似,且高浓度药根碱对FⅪ活性亦有抑制作用,但不影响FⅨ、FⅧ、FⅩ和FⅦ的活性,而抗凝药物肝素可显著降低FⅫ、FⅪ、FⅨ及FⅧ的活性,说明药根碱可能主要抑制内源性接触激活因子FⅫ的活性,通过FⅫ影响全程的接触激活内源性凝血途径,对其他凝血因子活性影响较小,其作用不同于肝素,不会导致严重的出血不良反应。采用Westernblot法檢测药根碱在体外对FⅫ蛋白激活的抑制作用,结果显示药根碱和CTI类似,均能显著抑制高岭土对FⅫ蛋白的激活。进一步说明药根碱可能以FⅫ为靶点,通过与FⅫ蛋白结合,抑制其激活而抑制内源性凝血途径,从而发挥抗凝血抗栓作用。
综上所述,药根碱具有确切的抗血栓作用,其与FⅫa对接良好,可显著延长APTT,通过抑制FⅫ蛋白激活,降低血浆FⅫ活性,其作用与肝素不同,且不影响血小板、抗凝和纤溶,表明药根碱可能主要作用于内源性凝血系统,可能通过抑制FⅫ蛋白激活、降低FⅫ活性而发挥抗栓作用,但具体的作用形式有待进一步阐明。
参考文献
[1] WHO. World health statistics 2018:
monitoring health for the SDGs sustainable development goals[R]. Geneva, WHO, 2018.
[2] 牧 童,赵思宁,杨 慧,等.抗血栓药物研究进展[J].广州化工, 2020,48(11):5-8,21.
[3] MEGA J L, SIMON T. Pharmacology of antithrombotic drugs:
An assessment of oral antiplatelet and anticoagulant treatments[J]. The Lancet, 2015, 386(9990):
281-291.
[4] 贺石林,王东生,文志斌,等.内在凝血途径的接触激活:
抗血栓形成研究的新靶点[J].血栓与止血学,2015,21(1):57-64.
[5] WHEELER A P, GAILANI D. The intrinsic pathway of coagulation as a target for antithrombotic therapy[J]. Hematology/Oncology Clinics of North America, 2016, 30(5):
1099-1114.
[6] DAVID T, KIM Y C, ELY L K, et al. Factor XIa-specific IgG and a reversal agent to probe factor Ⅺfunction in thrombosis and hemostasis[J]. Science Translational Medicine, 2016, 8(353):
353ra112.
[7] 朱水兰,雷 婷,高 旭,等.药根碱多重调控脂肪胰岛素抵抗细胞葡萄糖转运蛋白的降糖效应研究[J].中国中药杂志,2018,43(6):1215-1220.
[8] QIU H W, SUN S N, MA X M, et al. Jatrorrhizine hydrochloride suppresses proliferation, migration, and secretion of synoviocytes in vitro and ameliorates rat models of rheumatoid arthritis in vivo[J]. International Journal of Molecular Sciences, 2018, 19(5):
1514.
[9] WU H, HE K, WANG Y Z, et al. The antihypercholesterolemic effect of jatrorrhizine isolated from Rhizoma Coptidis[J]. Phytomedicine, 2014, 21(11):
1373-1381.
[10] 刘惠娜,曹 旺,邹 芳,等.药根碱抗大鼠动脉血栓和静脉血栓形成作用的研究[J].中药药理与临床,2020,36(2):126-132.
[11] 严宝飞,刘 嘉,段金廒,等.基于UPLC法和网络药理学的黄芩茎叶防治新型冠状病毒肺炎潜在作用机制研究[J].药物评价研究, 2020,43(6):991-1002.
[12] RENNé T. The procoagulant and proinflammatory plasma contact system[J]. Seminars in Immunopathology, 2012, 34(1):
31-41.
[13] MAAS C, RENNé T. Coagulation factor Ⅻ in thrombosis and inflammation[J]. Blood, 2018, 131(17):
1903-1909.
[14] RENNé T, SCHMAIER A H, NICKEL K F, et al. In vivo roles of factor Ⅻ[J]. Blood, 2012, 120(22):
4296-4303.
[15] RENNé T, POZGAJOVá M, GRüNER S, et al. Defective Thrombus formation in mice lacking coagulation factor Ⅻ[J]. The Journal of Experimental Medicine, 2005, 202(2):
271-281.
[16] CHENG Q F, TUCKER E I, PINE M S, et al. A role for factor Ⅻa-mediated factor Ⅺactivation in Thrombus formation in vivo[J]. Blood, 2010, 116(19):
3981-3989.
[17] LARSSON M, RAYZMAN V, NOLTE M W, et al. A factor Ⅻa inhibitory antibody provides thromboprotection in extracorporeal circulation without increasing bleeding risk[J]. Science Translational Medicine, 2014, 6(222):
222ra17.
[18] VON BR?HL M L, STARK K, STEINHART A, et al. Monocytes, neutrophils, and platelets cooperate to initiate and propagate venous thrombosis in mice in vivo[J]. The Journal of Experimental Medicine, 2012, 209(4):
819-835.
[19] KENNE E, NICKEL K F, LONG A T, et al. Factor Ⅻ:
A novel target for safe prevention of thrombosis and inflammation[J]. Journal of Internal Medicine, 2015, 278(6):
571-585.
[20] YAU J W, LIAO P, FREDENBURGH J C, et al. Selective depletion of factor Ⅺor factor Ⅻ with antisense oligonucleotides attenuates catheter thrombosis in rabbits[J]. Blood, 2014, 123(13):
2102-2107.
[21] MAY F, KRUPKA J, FRIES M, et al. FⅫa inhibitor rHA-Infestin-4:
Safe thromboprotection in experimental venous, arterial and foreign surface-induced thrombosis[J]. British Journal of Haematology, 2016, 173(5):
769-778.
[22] XU Y M, CAI T Q, CASTRIOTA G, et al. Factor Ⅻa inhibition by Infestin-4:
In vitro mode of action and in vivo antithrombotic benefit[J]. Thrombosis and Haemostasis, 2014, 111(4):
694-704.
[23] BOUCKAERT C, SERRA S, RONDELET G, et al. Synthesis, evaluation and structure-activity relationship of new 3-carboxamide coumarins as FⅫa inhibitors[J]. European Journal of Medicinal Chemistry, 2016, 110:
181-194.
[24] 阮 灝,马晓娟,孙明月,等.益气活血中药抗血栓作用研究进展[J].中西医结合心脑血管病杂志,2019,17(1):71-74.
[25] 华 芳,赵玉玲,李 莞,等.川芎及其中成药抗凝血作用测定方法的研究[J].中草药,2019,50(7):1698-1702.
[26] 柳吉玲.活血化瘀药抗血栓作用的研究进展[J].中国当代医药, 2013,20(35):15-17.
猜你喜欢 凝血因子 液体复苏结合参附注射液治疗严重创伤失血性休克的临床效果中外医学研究(2020年17期)2020-09-02减低剂量凝血因子替代治疗在血友病患者微创手术中的疗效医学信息(2020年12期)2020-07-27左心室相关指标及凝血因子与冠心病介入治疗预后的关系探究中国医学创新(2020年14期)2020-06-08不同原料血浆制备的冷沉淀对凝血因子Ⅷ及纤维蛋白原的影响 杨中国当代医药(2019年24期)2019-10-30血型实验室的输血检验质量和输血安全控制探究及对凝血因子的影响中外医疗(2019年7期)2019-05-24血型实验室的输血检验质量和输血安全控制探究及对凝血因子的影响分析中外医疗(2019年1期)2019-03-29卡前列素氨丁三醇与宫缩素治疗产后出血的效果比较中国当代医药(2018年19期)2018-11-10补阳还五汤联合丹参川芎嗪治疗急性脑梗死的疗效及对凝血因子和血液黏度的影响中西医结合心血管病电子杂志(2018年34期)2018-02-24选择性子宫动脉栓塞在产后出血合并血栓患者中的效果及对凝血因子的影响研究中西医结合心血管病电子杂志(2017年27期)2018-02-07双侧子宫动脉上行支结扎联合米索前列醇在产后出血患者中的应用及对凝血因子的影响中国当代医药(2017年36期)2018-01-23




