梁桂洪 黄和涛 潘建科 曾令烽 杨伟毅 罗明辉 杨园 陈红云 韩燕鸿 赵金龙 刘军

摘 要 目的:探索龍鳖胶囊含药血清(后文简写为“LBJN”)对Yes结构结合蛋白(YAP)抑制剂维替泊芬(verteporfin)诱导软骨细胞凋亡的保护作用及机制。方法:通过两步酶消化法提取原代人膝骨性关节炎软骨细胞,利用甲苯胺蓝染色法和Ⅱ型胶原蛋白免疫荧光染色法对细胞进行鉴定。采用流式细胞术检测2、5 μmol/L verteporfin单用和分别与5%LBJN联用48 h后对细胞凋亡的影响,并设置溶剂对照[0.1%二甲基亚砜(DMSO)]和5%LBJN对照。采用Western blot法检测0.1%DMSO(溶剂对照)、2 μmol/L verteporfin、2 μmol/L verteporfin+5%LBJN和0(空白对照)、2.5%LBJN、5%LBJN处理48 h后细胞中凋亡相关蛋白[YAP、B细胞淋巴瘤2(Bcl-2)、活化胱天蛋白酶3(cleaved-caspase-3)]的表达水平;采用Western blot法检测0(空白对照)、2.5%、5%LBJN处理48 h后细胞中自噬相关蛋白[哺乳动物雷帕霉素靶蛋白(mTOR)、Beclin-1、LC3A/B ]的表达水平。结果:分离出的细胞符合软骨细胞的特征。与0.1%DMSO比较,2、5 μmol/L verteporfin作用后细胞的凋亡率均显著升高(P<0.05),且两个浓度的作用效果相当(P>0.05);与单用verteporfin比较,2、5 μmol/L verteporfin与5%LBJN联用后细胞的凋亡率均显著降低(P<0.05)。与0.1%DMSO比较,2 μmol/L verteporfin作用后细胞中YAP、Bcl-2蛋白表达水平均显著降低(P<0.05),而cleaved-caspase-3蛋白表达水平显著升高(P<0.05);与2 μmol/L verteporfin比较,2 μmol/L verteporfin+5%LBJN作用后细胞中YAP、Bcl-2蛋白的表达水平均显著升高(P<0.05),而cleaved-caspase-3蛋白的表达水平显著降低(P<0.05)。与空白对照比较,2.5%、5%LBJN作用后细胞中YAP、Bcl-2、Beclin-1蛋白的表达水平和LC3A/B-Ⅱ/LC3A/B-Ⅰ比值均显著升高(P<0.05),而cleaved-caspase-3、mTOR蛋白的表达水平均显著降低(P<0.05)。结论:LBJN具有阻断YAP抑制剂verteporfin诱导的软骨细胞凋亡的作用,其机制可能与调节软骨细胞中凋亡相关蛋白的表达和增强软骨细胞的自噬有关。
关键词 龙鳖胶囊;含药血清;骨性关节炎;软骨细胞;Yes结构结合蛋白抑制剂;凋亡;自噬
ABSTRACT OBJECTIVE:
To explore the protective effects of Longbie capsule contained serum (called “LBJN” for short) on the apoptosis of chondrocytes induced by YAP inhibitor verteporfin and its mechanism. METHODS:
Primary human knee osteoarthritis(OA) chondrocytes were extracted by two-step enzymatic digestion, and then identified by toluidine blue staining and type Ⅱ collagen immunofluorescence staining. The effects of 2, 5 μmol/L verteporfin alone or combined with 5%LBJN on cell apoptosis were detected by flow cytometry. Solvent control(0.1% DMSO) and 5% LBJN were set. Western blot assay was adopted to detect the expression of apoptosis related proteins (YAP, Bcl-2, cleaved-caspase-3) after treated with 0.1%DMSO (solvent control), 2 μmol/L verteporfin, 2 μmol/L verteporfin+5%LBJN和0(blank control), 2.5% LBJN and 5% LBJN for 48 h. The expression of autophagy related proteins (mTOR, Beclin-1, LC3A/B) after treated with 0(blank control), 2.5%, 5% LBJN for 48 h were detected by Western blot assay. RESULTS:
The isolated cells accorded with the characteristics of chondrocytes. Compared with 0.1%DMSO, the apoptosis rates of cells were increased significantly after treated with 2, 5 μmol/L verteporfin (P<0.05), and the effects of the two concentrations were similar (P>0.05). Compared with verteporfin alone, 2, 5 μmol/L verteporfin combined with 5%LBJN could significantly decrease the apoptotic rate of cells (P<0.05). Compared with 0.1%DMSO, the protein expression of YAP and Bcl-2 were decreased significantly after treated with 2 μmol/L verteporfin (P<0.05), while the protein expression of cleaved-caspase-3 were increased significantly(P<0.05). Compared with 2 μmol/L verteporfin, protein expression of YAP and Bcl-2 were increased significantly after treated with 2 μmol/L verteporfin+5%LBJN (P<0.05), while the protein expression of cleaved-caspase-3 were decreased significantly(P<0.05). Compared with blank control, the protein expression of YAP,Bcl-2 and Beclin-1 were increased significantly after treated with 2.5%, 5%LBJN (P<0.05), while protein expression of cleaved-caspase-3 and mTOR were decreased significantly (P<0.05). CONCLUSIONS:
LBJN can block the apoptosis of chondrocytes induced by YAP inhibitor verteporfin, and its mechanism may be related to regulating the expression of apoptosis related proteins and enhancing autophagy of chondrocytes.
KEYWORDS Longbie capsule; Contained serum; Osteoarthritis; Chondrocytes; YAP inhibitor; Apoptosis; Autophagy
骨性关节炎(osteoarthritis,OA)是以关节软骨的破坏性改变为主要病理特征的慢性退行性疾病[1]。软骨细胞发生凋亡是导致关节软骨退变的主要因素,因此抑制软骨细胞凋亡是缓解软骨退变的有效途径[2]。Yes结构结合蛋白(YAP)是Hippo信号通路下游的效应因子,同时也是转录共激活因子,其不仅能参与调节细胞的增殖、凋亡、侵袭和迁移等各项生物学行为,而且还能以不同的方式调控软骨细胞的成熟和分化,并能维持软骨细胞的软骨表型[3-4]。因此,本课题组拟利用YAP抑制剂维替泊芬(verteporfin)诱导软骨细胞发生凋亡,借此探索药物对软骨细胞凋亡的影响。
中医学认为,OA的主要病机是肾虚血瘀,因此补肾活血是该病对应的治则[5]。本课题组前期通过循证研究证实了补肾活血中药在治疗OA方面具有确切的疗效[6]。在补肾活血治则的指导下,本院骨伤科研发了补肾活血中药龙鳖胶囊,该方由巴戟天、仙茅等多味中药组成。方中以巴戟天、仙茅为君药,温肾助阳;土鳖虫、全蝎、蜈蚣、蕲蛇等为臣药,透骨搜风、通络止痛;丹参、制川乌等为佐药,活血化瘀、散寒止痛;黄芪、牛膝为使药,益气升阳、补肝肾、强筋骨,引药下行。诸药合用,共奏补肾活血之效。该方在临床上用于治疗OA取得了较为满意的疗效[7]。同时,本课题组前期通过动物实验发现,龙鳖胶囊具有抑制OA炎症反应的作用[8]。然而,该方对软骨细胞增殖和凋亡等相关生物学行为的影响尚不明确,阻碍了其后续改良和研发。
中药复方含药血清可模拟药物在人体内的代谢过程,从而准确地反映药物在体外实验中的实际情况[9]。因此,本课题组拟利用血清药理学方法[10],探索龙鳖胶囊含药血清(后文简写为“LBJN”)对体外OA软骨细胞凋亡的影响。此外,有研究表明,软骨细胞自噬失调是软骨退行性病变的重要特征之一[11-13],而且通过上调细胞的自噬水平可抑制软骨细胞凋亡[14]。因此,本课题组拟同时研究LBJN对OA软骨细胞自噬水平的影响,为揭示补肾活血中药龙鳖胶囊防治OA的分子机制提供参考。
1 材料
1.1 主要仪器
TI2-E型荧光倒置显微镜购自日本Nikon公司;Novo Quanteon型流式细胞仪购自安捷伦生物(杭州)有限公司;Advantage A10型纯水系统购自美国Millipore公司;Forma 型CO2培养箱、A2型生物安全柜均购自美国Thermo Fisher Scientific公司;ChemiDoc Touch型高灵敏度化学发光成像分析系统购自美国Bio-Rad公司;M1000 Pro型多功能酶标仪购自瑞士Tecan公司。
1.2 主要药品与试剂
龙鳖胶囊(批准文号为粤药制字Z20071030,规格为每粒0.5 g)由广东省中医院药剂中心生产,成人剂量为每次2 g、每天给药3次;青-链霉素双抗(批号15140-122)、高糖DMEM培养基(批号C11995500BT)、澳洲胎牛血清(批号10099141)、含乙二胺四乙酸(EDTA)的0.25%胰酶(批号25200072)、0.25%胰酶(批号15050065)、磷酸盐缓冲液(PBS,pH 7.4)均购自美国Gbico公司;二甲基亚砜(DMSO)、Ⅱ型胶原蛋白酶(批号C6885)均购自美国Sigma公司;YAP抑制剂verteporfin原料药(批号S1786,纯度99.31%)购自美国Selleck公司;甲苯胺蓝染色液试剂盒(批号G3663)购自北京索莱宝科技有限公司;二喹啉甲酸(BCA)蛋白质定量检测试剂盒(批号K300)购自上海博彩生物科技有限公司;FITC/Annexin V凋亡检测试剂盒(批号556547)购自美国BD公司;发光试剂ECL试剂盒(批号WBKLS0100)购自美国Millipore公司;Western及碘化丙啶(PI)细胞裂解液(批号P0013)、苯甲基磺酰氟(PMSF,批号ST506)、蛋白酶抑制剂混合物(批号P1005)均购自上海碧云天生物技术有限公司;兔抗人YAP单克隆抗体(批号14074)、兔抗人B细胞淋巴瘤2(Bcl-2)单克隆抗体(批号3498)、兔抗人活化胱天蛋白酶3(cleaved-caspase-3)单克隆抗體(批号9664)、兔抗人哺乳动物雷帕霉素靶蛋白(mTOR)单克隆抗体(批号2983)、兔抗人自噬相关蛋白Beclin-1单克隆抗体(批号3495)、兔抗人自噬相关蛋白LC3A/B单克隆抗体(批号12741)、小鼠抗人β-肌动蛋白(β-actin)单克隆抗体(批号3700)、辣根过氧化物酶(HRP)标记的山羊抗兔免疫球蛋白G(IgG)二抗(批号7074)、HRP标记的山羊抗鼠IgG二抗(批号7076)均购自美国CST公司;兔抗人Ⅱ型胶原蛋白(ColⅡ)多克隆抗体(批号ab34712)购自美国Abcam公司;其余试剂均为分析纯或实验室常用规格,水为超纯水。
1.3 动物
SPF级SD大鼠10只,1.5月龄,雌雄各半,体质量为(200±10) g,由南方医科大学实验动物中心提供,实验动物质量合格号44002100025404,实验动物使用许可证号为SYXK(粤)2018-0094。大鼠购入后于广东省中医药科学院实验动物中心SPF级环境中饲养,饲养期间自由饮水和进食。本研究的动物实验方案由广东省中医院动物伦理委员会批准后实施。
1.4 人OA关节软骨组织
在获得于广东省中医院明确诊断为原发性膝关节OA并住院行关节置换术患者的知情同意后,收集其术后丢弃的关节软骨组织样本,用以提取原代OA软骨细胞。本研究临床组织样本的获取过程严格遵循《赫尔辛基宣言》以及我国有关临床试验研究法规、规范进行,并由广东省中医院医学伦理委员会审核、批准后实施,伦理批件号为BE2019-103。
2 方法
2.1 LBJN的制备
根据龙鳖胶囊的成人临床用量,按体表面积法换算得大鼠的使用剂量为0.625 g/kg,于每天9:00和15:00左右根据大鼠体质量分别灌胃给药(以水为溶剂,灌胃体积为2 mL)1次,连续灌胃7天。末次灌胃1 h后,在大鼠麻醉状态下于腹主动脉采血,将血样以3 000 r/min离心10 min,收集上清液(即为含药血清),随后在56 ℃水浴中孵育、灭活30 min,然后用0.22 μm针头过滤器过滤除菌。将10只大鼠的血清独立分装后放置在-80 ℃冰箱中保存,备用。
2.2 原代人OA软骨细胞的提取与鉴定
通过两步酶消化法提取原代人膝关节OA软骨细胞。取患者因膝关节置换手术而丢弃的关节软骨组织,置于50 mL离心管中(含1%青-链霉素双抗的PBS),将软骨组织剪成大小约0.5 cm×0.5 cm的碎片,加入适量0.25%胰酶,在37 ℃摇床上以180 r/min振荡30 min;随后,将软骨组织剪成大小约0.1 cm×0.1 cm的小碎片,加入0.2%Ⅱ型胶原蛋白酶,继续在37 ℃摇床上以180 r/min振荡4 h。结束后,将细胞悬液过200目筛网,然后以1 500 r/min离心5 min,弃去上清液;细胞沉淀以PBS重悬后,以1 500 r/min 离心5 min,弃去上清液;用含1%青-链霉素双抗和10%胎牛血清的高糖DMEM培养基重悬细胞,并将其接种于含上述培养基的培养瓶中,常规培养3天后首次换液,之后按常规细胞培养方式进行培养和传代。取第2或第3代细胞,采用甲苯胺蓝染色法和ColⅡ免疫荧光染色法对其进行鉴定[15]。
2.3 细胞凋亡检测
采用流式细胞术进行检测。取“2.2”项下对数生长期的OA软骨细胞,用含EDTA的0.25%胰酶消化后,制成密度为5×104 mL-1的细胞悬液,按每孔2 mL接种到6孔板中,常规培养24 h。将细胞分为溶剂对照组[0.1%二甲基亚砜(DMSO)]、2 μmol/L verteporfin组(verteporfin以0.1%DMSO溶解,下同)、5 μmol/L verteporfin组、5%LBJN组、2 μmol/L verteporfin+5%LBJN组和5 μmol/L verteporfin+5%LBJN组,每组设置2个复孔(各组浓度均根据前期预实验结果设置)。各组细胞经相应试剂或药物处理48 h后,收集各孔上清液,以3 000 r/mim离心5 min后,弃去上清液;用不含EDTA的0.25%胰酶消化并收集细胞,然后以3 000 r/mim离心5 min,弃去上清液;用PBS重悬细胞,然后以3 000 r/mim离心5 min,弃去上清液;用1×binding buffer100 μL重悬细胞,然后每孔分别加入FITC、PI染料各5 μL,轻轻混匀,常温下避光孵育15 min。孵育结束后,用1×binding buffer 400 μL重悬细胞,然后转移至流式管中,上机检测。实验重复3次。
2.4 细胞中凋亡相关蛋白YAP、Bcl-2、cleaved-caspase-3表达检测
采用Western blot法进行检测。取“2.2”项下对数生长期的OA软骨细胞,用含EDTA的0.25%胰酶消化后,制成密度为2×105 mL-1的细胞悬液,按每孔2 mL接种到6 cm皿中,常规培养24 h。将细胞分为溶剂对照组(0.1%DMSO)、2 μmol/L verteporfin组、2 μmol/L verteporfin+5%LBJN组和不同浓度[0(空白对照)、2.5%、5%]LBJN组。各组细胞经相应试剂或药物处理48 h后,收集各孔细胞,以5 000 r/mim离心5 min,弃去上清液;沉淀加入适量细胞裂解液(Western及PI细胞裂解液-PMSF-蛋白酶抑制剂混合物=100 ∶ 1 ∶ 1,V/V/V),充分裂解后,以12 000 r/mim离心10 min,收集上清液,采用BCA法测定蛋白浓度。将蛋白高温变性后,取变性蛋白在60 V电压下行十二烷基硫酸钠-聚丙烯酰胺凝胶电泳30 min,再调节电压至100 V继续电泳1 h,然后在245 mA电流下转膜(聚偏二氟乙烯膜)90 min。以5%脱脂奶粉室温封闭1 h,分别加入稀释比例均为1 ∶ 1 000的YAP、Bcl-2、cleaved-caspase-3一抗和稀釋比例为1 ∶ 2 000的β-actin一抗,4 ℃下孵育过夜;以TBST溶液洗膜5 min×3次,加入稀释比例均为1 ∶ 1 000的相应二抗,室温下孵育1 h;以TBST溶液洗膜5 min×3次,加入ECL显色,放入化学发光成像分析系统中曝光显影。采用Image J 1.46 r软件测定蛋白条带的灰度值,以目标蛋白与内参蛋白(β-actin)条带灰度值的比值表示目标蛋白的表达水平。实验重复3次,结果分别以溶剂或空白对照组为参照进行标准化处理。
2.5 细胞中自噬相关蛋白mTOR、 Beclin-1和LC3A/B的检测
采用Western blot法进行检测。按“2.4”项下方法制备细胞悬液、接种并常规培养24 h。将细胞分为0(空白对照)、2.5%LBJN、5%LBJN组。各组细胞经相应试剂或药物作用48 h后,检测细胞中mTOR、Beclin-1和LC3A/B蛋白的表达水平。其中,mTOR、Beclin-1、LC3A/B一抗稀释比例均为1 ∶ 1 000,HRP标记的山羊抗兔IgG二抗的稀释比例为1 ∶ 1 000,其余条件均同“2.4”项下。实验重复3次,结果以空白对照组为参照进行标准化处理。
2.6 统计学方法
采用SPSS 20.0软件对数据进行统计分析。计量资料以x±s表示,多组间比较采用单因素方差分析,组间两两比较采用LSD检验。P<0.05表示差异具有统计学意义。
3 结果
3.1 人OA软骨细胞的提取和鉴定结果
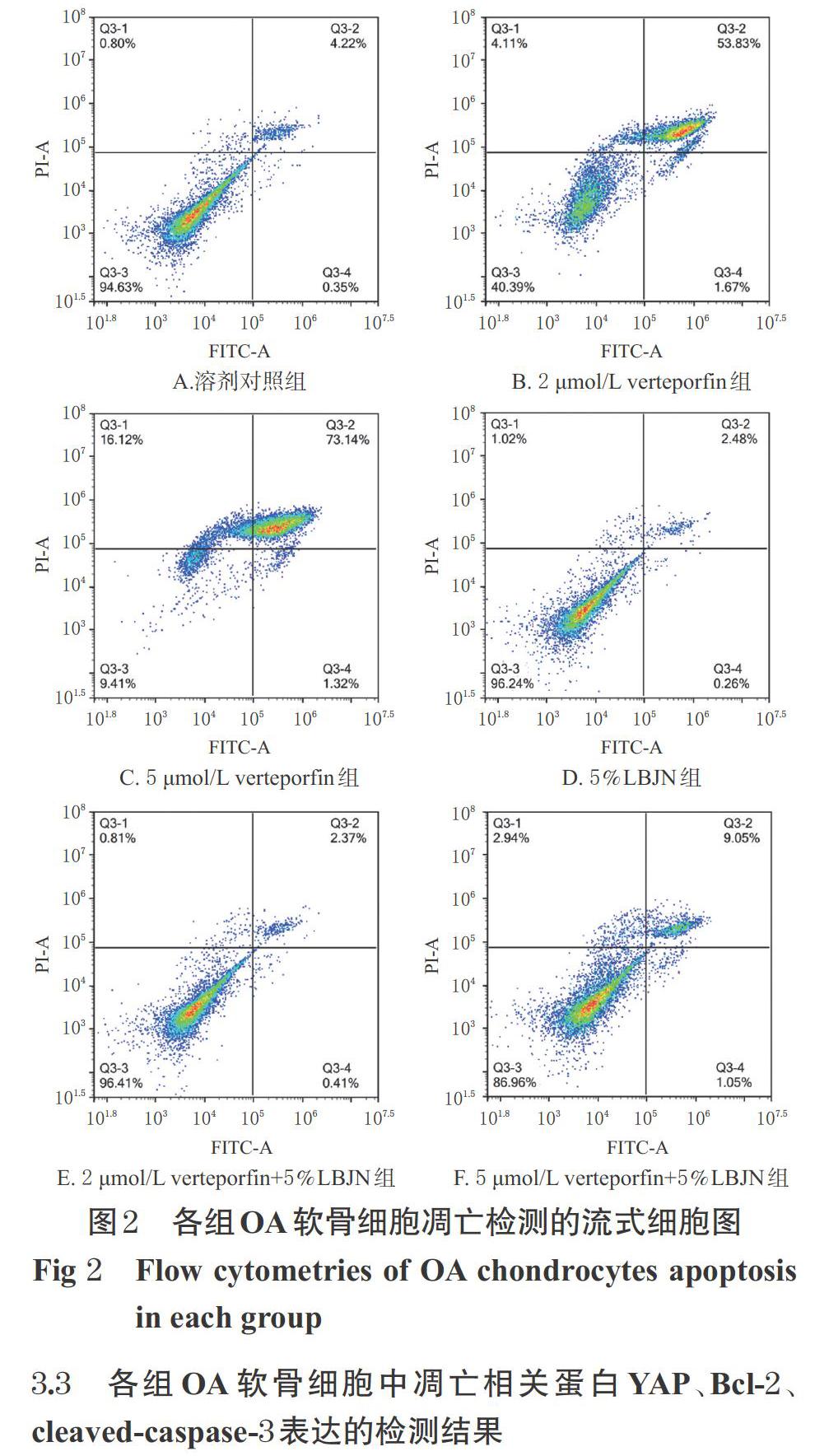
细胞经分离后正常贴壁生长,于倒置显微镜下观察到其呈长梭形和多边形(图1A)。经甲苯胺蓝染色后,细胞核呈深蓝色,细胞质颜色则较浅;细胞界限清楚,呈长梭形或多边形(图1B)。经免疫荧光染色后,细胞均表现出较强的红色荧光(图1C),表明ColⅡ荧光染色为阳性(ColⅡ是构成软骨基质的主要成分之一,故可通过检测其表达情况对软骨细胞进行鉴定[16])。以上结果均符合OA软骨细胞的特征,故鉴定分离出的细胞为OA软骨细胞。
3.2 细胞凋亡的检测结果
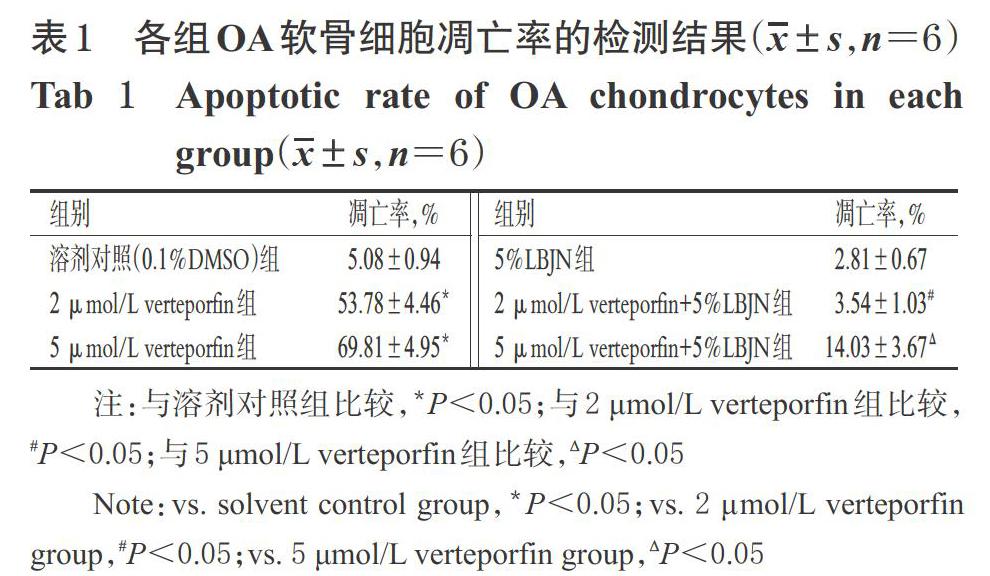
与溶剂对照组比较,2、5 μmol/L verteporfin组细胞的凋亡率均显著升高(P<0.05),且2、5 μmol/L verteporfin组细胞凋亡率组间比较差异无统计学意义(P>0.05)。以上结果表明,2、5 μmol/L verteporfin均可诱导细胞凋亡,且两个浓度的作用效果相当。与溶剂对照组比较,5%LBJN组细胞凋亡率的差异无统计学意义(P<0.05),表明正常情况下LBJN对细胞凋亡无影响;与单用verteporfin组比较,对应浓度的verteporfin+LBJN联用组细胞的凋亡率均显著降低(P<0.05),表明LBJN具有抑制软骨细胞凋亡的作用。各组OA软骨细胞凋亡检测的流式细胞图见图2,凋亡率的检测结果见表1。
3.3 各组OA软骨细胞中凋亡相关蛋白YAP、Bcl-2、cleaved-caspase-3表达的检测结果
与溶剂对照组比较,2 μmol/L verteporfin组细胞中YAP、Bcl-2蛋白的表达水平均显著降低(P<0.05),而cleaved-caspase-3蛋白的表达水平显著升高(P<0.05);与2 μmol/L verteporfin组比较,2 μmol/L verteporfin+5%LBJN组细胞中YAP、Bcl-2蛋白的表达水平均显著升高(P<0.05),而cleaved-caspase-3蛋白的表达水平显著降低(P<0.05)。与空白对照组比较,2.5%、5%LBJN组细胞中YAP、Bcl-2蛋白的表达水平均显著升高(P<0.05),而cleaved-caspase-3蛋白的表达水平均显著降低(P<0.05)。各组细胞中YAP、Bcl-2和cleaved-caspase-3蛋白表达的电泳图见图3,表达水平的检测结果见表2。
3.4 各组OA软骨细胞中自噬相关蛋白mTOR、 Beclin-1和LC3A/B表达的检测结果
与空白对照组比较,2.5%、5%LBJN组细胞中mTOR蛋白表达水平均显著降低(P<0.05),而Beclin-1蛋白表达水平和LC3A/B-Ⅱ/LC3A/B-Ⅰ比值均显著升高(P<0.05)。各组细胞中mTOR、Beclin-1和LC3A/B蛋白表达的电泳图见图4,表达水平的检测结果见表3。
4 讨论
关节软骨中的细胞外基质是维持正常软骨功能的重要物质,其由分布在关节软骨中唯一的软骨细胞分泌而成,而异常的软骨细胞凋亡是导致软骨细胞减弱或丧失相关分泌功能,从而导致关节软骨退变的主要病理因素[17-18]。因此,通过有效的途径抑制软骨细胞凋亡将可能成为防治OA的重要手段。相关研究发现,YAP可调控软骨细胞成熟、增殖、分化并維持软骨表型特征[19],且在OA软骨组织中YAP的表达下降[3]。因此,本研究利用YAP抑制剂verteporfin构建软骨细胞凋亡模型。通过流式细胞术检测后发现,2、5 μmol/L verteporfin均能促进软骨细胞凋亡;且与单用verteporfin组比较,对应浓度的verteporfin+LBJN联用组细胞的凋亡率均显著降低。以上结果表明,LBJN具有抑制软骨细胞凋亡的作用。Bcl-2是重要的凋亡抑制因子,其可通过抑制下游caspase-3的激活,有效地抑制细胞凋亡的发生[20]。caspase-3是细胞凋亡过程中最主要的终末剪切酶,而cleaved-caspase-3是caspase-3的活化形式,在细胞凋亡的发生过程中cleaved-caspase-3的表达水平会明显升高[21]。由于2、5 μmol/L verteporfin对软骨细胞凋亡的影响无明显差异,因此本研究以2 μmol/L verteporfin为凋亡诱导剂进行了后续凋亡相关蛋白表达的检测实验。结果发现,2 μmol/L verteporfin可下调细胞中Bcl-2蛋白并上调细胞中cleaved-caspase-3蛋白的表达;而5%LBJN则可上调细胞中Bcl-2蛋白的表达并下调cleaved-caspase-3蛋白的表达。这表明LBJN可能是通过调节凋亡相关蛋白的表达而起到抑制OA软骨细胞凋亡的作用。
细胞自噬是细胞自身通过降解其内部受损细胞器和大分子物质,利用物质的循环和再利用达到维持细胞稳态和正常功能的重要活动形式[22]。近年来有研究表明,软骨细胞自噬的增强可以抑制其凋亡和衰老,改善软骨基质代谢活性,从而延缓OA的进展[23]。细胞自噬过程受mTOR等基因的调控,抑制mTOR蛋白表达可诱导细胞自噬[24-25]。Beclin-1和LC3A/B均为自噬标记蛋白,其表达水平的高低可反映细胞自噬的情况。其中,Beclin-1是自噬体形成过程中所必需的重要元件,LC3A/B则是构成自噬体的重要结构[26]。当自噬形成时,胞浆型LC3A/B(即LC3A/B-Ⅰ)会转变为自噬体中的膜型LC3A/B(即LC3A/B-Ⅱ),因此可通过检测LC3A/B-Ⅱ/LC3A/B-Ⅰ比值的大小来判断细胞自噬的水平[26]。本研究结果显示,LBJN可抑制OA软骨细胞中mTOR蛋白的表达、上调细胞中Beclin-1蛋白的表达、升高细胞中LC3A/B-Ⅱ/LC3A/B-Ⅰ比值,从而提高软骨细胞的自噬水平。
綜上所述,LBJN具有阻断YAP抑制剂verteporfin致OA软骨细胞凋亡的作用,其作用机制可能与调节细胞中凋亡相关蛋白 YAP、Bcl-2、cleaved-caspase-3和自噬相关蛋白mTOR、 Beclin-1、LC3A/B的表达有关。因细胞凋亡与自噬水平之间调控关系复杂,后续将深入探索龙鳖胶囊是否可通过调节mTOR及其下游相关信号通路的活性来调控细胞的自噬水平,进一步阐明该方调控OA软骨细胞凋亡的作用靶点和分子机制。
参考文献
[ 1 ] HE Y,LI Z,ALEXANDER P G,et al. Pathogenesis of osteoarthritis:risk factors,regulatory pathways in chondrocytes,and rxperimental models[J]. Biology(Basel),2020,9(8):194.
[ 2 ] HWANG H S,KIM H A. Chondrocyte apoptosis in the pathogenesis of osteoarthritis[J]. Int J MolSci,2015,16(11):26035-26054.
[ 3 ] DENG Y J,LU J Q,LI W L,et al. Reciprocal inhibition of YAP/TAZ and NF-κB regulates osteoarthritic cartilage degradation[J]. Nature Communications,2018,9(1):4564.
[ 4 ] DELVE E,CO V,REGMI S C,et al. YAP/TAZ regulates the expression of proteoglycan 4 and tenascin C in superficial-zone chondrocytes[J]. Eur Cell Mater,2020,39:48- 64.
[ 5 ] 潘建科,洪坤豪,刘军,等.基于关联规则和复杂系统嫡聚类的膝骨关节炎用药规律研究[J].中国实验方剂学杂志,2015,21(12):229-232.
[ 6 ] 梁桂洪,梁祖建,林勇凯,等.补肾活血中药对比塞来昔布治疗膝骨性关节炎疗效与安全性的Meta分析[J].中国药房,2016,27(27):3810-3814.
[ 7 ] 潘建科,杨伟毅,刘军,等.龙鳖胶囊治疗膝骨关节炎临床疗效及其对生活质量的影响[J].中华中医药学刊,2017,35(3):558-561.
[ 8 ] 潘建科,谢辉,刘军,等.龙鳖胶囊对骨关节炎滑膜细胞p38 MAPK信号通路及NF-κB p65的调控研究[J].中华中医药学刊,2017,35(1):65-69,261-276.
[ 9 ] 策力木格,张小峰,苏都娜,等.血清药物化学在中药领域的应用现状[J].中国药房,2017,28(7):978-981.
[10] 李若飞,于春萍,兰丁璇,等.中药血清药理学实验方法与相关问题探讨[J/OL].全科口腔医学电子杂志,2019,6(31):125,136[2021-1-15]. http://wenku.baidu.com/view/d61394484935eefdc8d376eeaeaad1f34793117e.
[11] MUSUMECI G,CASTROGIOVANNI P,TROVATO F M,et al. Biomarkers of chondrocyte apoptosis and autophagy in osteoarthritis[J]. Int J MolSci,2015,16(9):20560- 20575.
[12] JIANG S,LIU Y,XU B,et al. Noncoding RNAs:new re- gulatory code in chondrocyte apoptosis and autophagy[J]. Wiley Interdiscip Rev RNA,2020,11(4):e1584.
[13] DUAN R,XIE H,LIU Z Z. The role of autophagy in osteoarthritis[J]. Front Cell DevBiol,2020,25(8):608388.
[14] YANG H,WEN Y,ZHANG M,et al. MTORC1 coordinates the autophagy and apoptosis signaling in articular chondrocytes in osteoarthritic temporomandibularjoint[J]. Autophagy,2020,16(2):271-288.
[15] 潘建科,谢辉,刘军,等.龙鳖胶囊对膝骨关节炎大鼠体质量及脏器指数的影响[J].中华中医药杂志,2016,31(8):3234-3237.
[16] 魏钰,魏民.人骨关节炎软骨细胞的体外分离与培养[J].中国组织工程研究,2019,23(25):4056-4061.
[17] THOMAS C M,FULLER C J,WHITTLES C E,et al. Chondrocyte death by apoptosis is associated with the initiation and severity of articular cartilage degradation[J]. Int J Rheum Dis,2011,14(2):191-198.
[18] BARRETO G,MANNINEN M,K EKLUND K. Osteoarthritis and Toll-like receptors:when innate immunity meets chondrocyte apoptosis[J]. Biology(Basel),2020,9(4):65.
[19] XIE W,XIAO W,TANG K,et al. Yes-associated protein 1:role and treatment prospects in orthopedic degenerative diseases[J]. Front Cell Dev Biol,2020,15(8):573455.
[20] WARREN C F A,WONG-BROWN M W,BOWDEN N A. Bcl-2 family isoforms in apoptosis and cancer[J]. Cell Death Dis,2019,10(3):177.
[21] SAVITSKAYA M A,ONISHCHENKO G E. Mechanisms of apoptosis[J]. Biochemistry(Mosc),2015,80(11):1393-1405.
[22] GALLUZZI L,GREEN D R. Autophagy-independent functions of the autophagy machinery[J]. Cell,2019,177(7):1682-1699.
[23] LUO P,GAO F,NIU D,et al. The role of autophagy in chondrocyte metabolism and osteoarthritis:a comprehensive research review[J]. Biomed Res Int,2019,2019:5171602.
[24] KIM Y C,GUAN K L. mTOR:a pharmacologic target for autophagy regulation[J]. J Clin Invest,2015,125(1):25- 32.
[25] ZHANG Y,VASHEGHANI F,LI Y H,et al. Cartilage- specific deletion of mTOR upregulates autophagy and protects mice from osteoarthritis[J]. Ann Rheum Dis,2015,74(7):1432-1440.
[26] NEW J,THOMAS S M. Autophagy-dependent secretion:mechanism,factors secreted,and disease implications[J]. Autophagy,2019,15(10):1682-1693.
(收稿日期:2021-01-20 修回日期:2021-05-21)
(編辑:林 静)
猜你喜欢 批号软骨蛋白 细砂糖对法式蛋白糖的质量影响研究广东教育·职教版(2021年3期)2021-04-20氨糖,骨骼健康的营养专家家庭医药(2020年2期)2020-03-17结直肠癌组织中泛素化修饰蛋白的蛋白质组学分析分析化学(2019年3期)2019-03-30水通道蛋白的发现学校教育研究(2018年27期)2018-05-14保护关节软骨 多做中强度运动大众健康(2016年10期)2016-12-07兰州72批次中药材及饮片抽检不合格科学养生(2014年11期)2014-11-18气相色谱法测定速效心痛滴丸主要成分的研究中国医药导报(2011年27期)2011-12-31



